Kc is het acroniem dat staat voor de evenwichtsconstante in termen van concentratie van een bepaalde chemische reactie. Het wordt gebruikt wanneer we verwijzen naar het al dan niet tot stand brengen van evenwicht in een chemische reactie. Hiervoor is altijd een Kc-berekening nodig, waarbij gebruik wordt gemaakt van de concentraties in hoeveelheid stof van de reactiedeelnemers.
DE Kc interpretatie is heel eenvoudig, want wanneer:
Kc = 1, het reactiesysteem is in evenwicht;
Kc > 1, het systeem is niet in evenwicht en de directe reactie overheerst;
Kc < 1, het systeem is niet in evenwicht en de omgekeerde reactie overheerst.
Belangrijk is dat de interpretatie van Kc afhangt van kennis over de chemische balans.
We hebben er een chemische balans wanneer een chemische reactie omkeerbaar is, dat wil zeggen, het presenteert een directe reactie (reactanten vormen de producten) en inverse reactie (producten vormen de reactanten), en de voorwaartse reactiesnelheid is precies hetzelfde als de omgekeerde reactiesnelheid. Zie een voorbeeld:

In het bovenstaande voorbeeld hebben we een chemisch evenwicht (aangegeven door de twee pijlen), want er is a directe reactie (A+B vormt C+D) en de omgekeerde reactie (C+D vormen A+B). De coëfficiënten a, b, c, d maken de vergelijking in evenwicht.
Elk van de deelnemers aan een reactie heeft altijd een concentratie in hoeveelheid stof (mol/L). Met de concentratiewaarden kunnen we de Kc van de reactie berekenen. Om deze berekening uit te voeren, is het echter noodzakelijk om de Kc-uitdrukking samen te stellen.
De assemblage van de Kc-expressie gebruikt altijd hetzelfde patroon. Met dit patroon vermenigvuldigen we de concentraties van producten verheven tot hun respectievelijke exponenten en gedeeld door de vermenigvuldiging van reactanten verheven tot hun respectievelijke exponenten.
De Kc-uitdrukking voor het generieke saldo hieronder zou zijn:

Niet stoppen nu... Er is meer na de reclame ;)
Kc = [Ç]ç.[D]d
[DE]De.[B]B
In de uitdrukking van Kc gebruiken we nooit vaste deelnemers of vloeibaar water, omdat dit constante items in de reactie zijn.
Zie enkele voorbeelden:
Voorbeeld 1: Ammoniak Vorming Balans
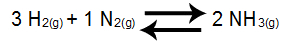
In de bovenstaande balans is het product NH3, die een coëfficiënt van 2 heeft, en de reactanten zijn H2 en dan2, die respectievelijk de coëfficiënten 3 en 1 presenteren. Alle evenwichtsdeelnemers zijn gasvormig, dus ze kunnen deel uitmaken van Kc. Op basis van deze gegevens wordt de Kc-expressie:
Kc = [NH3]2
[H2]3.[N2]1
Voorbeeld 2: Balans van de ontleding van calciumcarbonaat
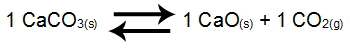
In de balans hierboven, de producten: CaO en de CO2en het reagens CaCO3hebben coëfficiënt 1. Hoe CaCO3 en CaO vast zijn, kunnen ze geen deel uitmaken van Kc. Op basis van deze gegevens zal de evenwichts-Kc-expressie zijn:
Kc = [CO2]1
OPMERKING: De uitdrukking heeft geen noemer omdat het reagens vast is. Dus laten we de uitdrukking zonder noemer of we zetten het cijfer 1 in de noemer (getal dat de standvastigheid van een deelnemer aangeeft).
Voorbeeld 3: Balans van ammoniumchloridevorming
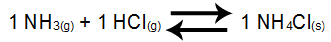
In het bovenstaande evenwicht zijn de NH-reagentia3 en het HCl en het NH-product4Cl hebben coëfficiënt 1. Als deelnemer van het NH-saldo4Cl is vast, het kan geen deel uitmaken van Kc. Op basis van deze gegevens zal de evenwichts-Kc-expressie zijn:
Kc = 1
[NH3]1.[HCl]1
OPMERKING: Omdat we geen saldodeelnemer in de teller hebben, is het noodzakelijk om het cijfer 1 (getal dat de standvastigheid van een deelnemer aangeeft) te plaatsen.
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Wat is Kc?"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kc.htm. Betreden op 28 juni 2021.
Wat is scheikunde?

Begrijp wat Kp is, de evenwichtsconstante in termen van druk, en weet hoe je deze kunt verkrijgen door drukken te gebruiken partiëlen van alle gassen die aanwezig zijn in een chemisch evenwicht, dat kan in atmosfeer (atm) of millimeter kwik zijn (mmHg). Klik hier en kom meer te weten over dit onderwerp!
Chemie

Test je kennis en leer meer met deze lijst met opgeloste oefeningen over chemische balansen. Door dit materiaal zul je beter kunnen begrijpen hoe je evenwichtsconstanten (Kp, Kc en Ki), evenwichtsverschuiving, pH en pOH, evenals evenwicht in zogenaamde bufferoplossingen kunt bewerken.