O Fasen diagram is een grafiek die wordt gebruikt om temperatuuromstandigheden aan te geven en druk nodig om een stof in zekere zin fysieke toestand (solide, vloeistof of gasvormig).
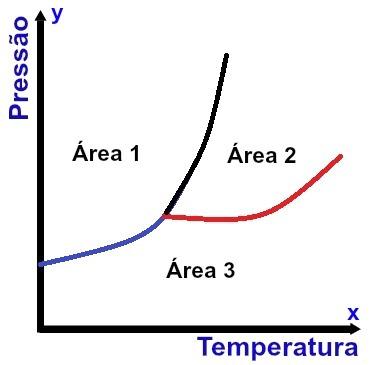
Weergave van een fasediagram
De x-as (horizontaal) bevat temperatuurwaarden en de y-as (verticaal) bevat drukwaarden. Bovendien zijn er drie curven verbonden met een enkel punt (een tripelpunt genoemd), die de grafiek in drie goed gedefinieerde gebieden verdelen, zoals te zien is in het bovenstaande diagram.
Naast het aangeven van de voorwaarden waaronder de stof zich in een specifieke fysieke toestand bevindt, Fasen diagram geeft de voorwaarden aan voor elke verandering in fysieke toestand.
Veranderingen in fysieke toestand zijn:
Fusie: overgang van vaste naar vloeibare toestand;
stollen: overgang van vloeibare naar vaste toestand;
Verdamping: overgang van vloeibare naar gasvormige toestand;
condensatie: overgang van gas naar vloeibare toestand;
sublimatie: overgang van vaste naar gasvormige toestand;
Resublimatie: overgang van gas naar vaste toestand.
a) Regio's
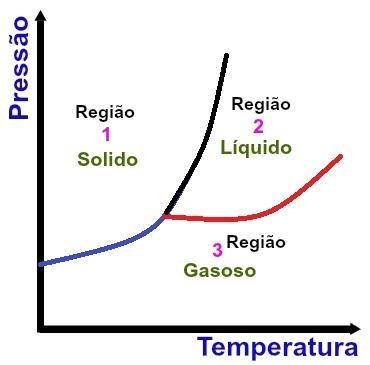
Fundamentele gebieden van een fasediagram
Regio 1
Regio 1 geeft de temperatuur- en drukomstandigheden aan waaronder we de stof in vaste toestand aantreffen.
Regio 2
Regio 2 geeft de temperatuur- en drukomstandigheden aan waarin we de stof in vloeibare toestand aantreffen.
Regio 3
Regio 3 geeft de temperatuur- en drukomstandigheden aan waarin we de stof in gasvormige toestand aantreffen.
b) Curven

Curven aanwezig in een fasediagram
Kromme A (paarse curve)
Het is de curve die het vaste en gasvormige gebied van het fasediagram verdeelt en wordt gewoonlijk de resublimatiecurve genoemd. Elk punt op kromme 1 geeft aan dat we een bepaalde stof hebben die naast elkaar bestaat in vaste en gasvormige toestanden.
Niet stoppen nu... Er is meer na de reclame ;)
Naast het aangeven van coëxistentie, geeft curve 2 ook de temperatuur- en drukomstandigheden aan voor de transformatie van een stof van een vloeibare naar een gasvormige toestand.
Kromme B (zwarte kromme)
Het is de curve die het vaste en vloeibare gebied van het fasediagram verdeelt en wordt gewoonlijk de stollingscurve genoemd. Elk punt op kromme 2 geeft aan dat we een bepaalde stof hebben die naast elkaar bestaat in een vaste en een gasvormige toestand.
Naast het aangeven van coëxistentie, geeft curve 2 ook de temperatuur- en drukomstandigheden aan voor de transformatie van een stof die zich in een vloeibare toestand bevindt naar een vaste toestand.
Kromme C (rode curve)
Het is de curve die het vaste en gasvormige gebied van het fasediagram verdeelt en wordt gewoonlijk de condensatiecurve genoemd. Elk punt op kromme 3 geeft aan dat we een bepaalde stof hebben die naast elkaar bestaat in een vaste en een gasvormige toestand.
Naast het aangeven van coëxistentie, geeft curve 3 ook de temperatuur- en drukomstandigheden aan voor de transformatie van een stof van een vaste naar een gasvormige toestand en vice versa.
c) Het drievoudige punt
Het punt waar de drie krommen in het fasediagram samenkomen, wordt het tripelpunt genoemd. Op dit punt hebben we de temperatuurwaarde en de drukwaarde waarbij we de stof tegelijkertijd in vaste, vloeibare en gasvormige toestand vinden.

d) Veranderingen in de fysieke toestand in het fasediagram
In het onderstaande fasediagram hebben we 6 pijlen die de richting aangeven van veranderingen in fysieke toestanden van een stof.

Pijl 1: geeft de fusie aan
Pijl 2: geeft stolling aan
Pijl 3: geeft verdamping aan
Pijl 4: geeft condensatie aan
Pijl 5: geeft sublimatie aan
Pijl 6: geeft hersublimatie aan
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Wat is een fasediagram?"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-diagrama-fases.htm. Betreden op 28 juni 2021.
Chemie

Vloeistoftransformaties, verdamping, intermoleculaire krachten, vloeibare superfreezing, vloeibare kristallisatie, blussen, vloeibare viscositeit, vloeibare dampdruk, atmosferische druk, vloeistof bevriezing, temperatuur-
Chemie

Vloeistoffen, Oppervlaktespanning, samensmelting van een vaste stof, condensatie van een gas, viscositeit, vloeistof, constant volume, moleculen van een gas, intermoleculaire krachten, compressie, verdamping van een vloeistof.

