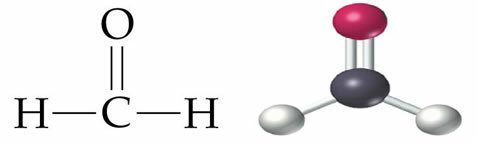Koolstof heeft vier elektronen in zijn valentieschil, wat betekent dat het vier bindingen kan vormen, zodat het zich bij andere atomen kan voegen. als: H, O, N, Kl. Deze eigenschap die koolstof heeft, verklaart de verscheidenheid aan organische verbindingen die in de natuur voorkomen, daarom wordt gezegd dat koolstof vierwaardig.
In het jaar 1874 creëerden Van’t Hoff en Le Bel een ruimtelijk model voor koolstof. Dit model had koolstofatomen vertegenwoordigd door regelmatige tetraëders, waarbij koolstof het midden van de tetraëder bezette en de vier valenties correspondeerden met de vier hoekpunten.

Ruimtelijke formule van koolstof.
In dit model werden de verschillende soorten bindingen die optreden tussen koolstofatomen als volgt weergegeven:
De) eenvoudige link - tetraëders zijn verbonden door een hoekpunt (enkele binding);


b) Dubbele binding - de tetraëders zijn verbonden door twee hoekpunten (een rand);


c) Drievoudige koppeling - de tetraëders zijn verbonden door drie hoekpunten (één vlak);
Niet stoppen nu... Er is meer na de reclame ;)


De evolutie van het atoommodel toonde aan dat het atoom een kern en een elektrosfeer heeft, wat de opkomst van nieuwe modellen mogelijk maakte om de bindingen gemaakt door koolstof te verklaren: in het jaar 1915 presenteerde Lewis een nieuw voorstel voor de binding van de atomen van koolstof. Volgens Lewis zijn atomen verbonden door elektronische paren in de valentielaag. Deze weergave werd de Lewis Electronic Formula genoemd en het type binding waarin atomen zich verbinden via elektronische paren staat bekend als covalente binding.
Lewis elektronische formule
De overgrote meerderheid van organische moleculen is driedimensionaal, dus er is behoefte aan modellen die niet alleen de structuur, maar ook de geometrie laten zien. Daarom is de ruimtelijke formule meer geschikt om de structuur van koolstof te begrijpen.
Door Liria Alves
Afgestudeerd in scheikunde
Brazilië School Team
Organische chemie - Chemie - Brazilië School
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
SOUZA, Liria Alves de. "Koolstofstructuurformules"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/formulas-estruturais-carbono.htm. Betreden op 28 juni 2021.