DE hydrolyse constante (Kh) verwijst naar a chemische balans vastgesteld uit de hydrolyse van een zout (chemische reactie waarbij een oplosbaar zout en water betrokken zijn).
Als de constante van elk ander evenwicht, de uitdrukking van hydrolyse constante is als volgt opgebouwd uit het product van productconcentraties gedeeld door het product van reagensconcentraties:
Kh = [producten]
[reagentia]
Werken met de hydrolyseconstante omvat kennis van drie belangrijke fenomenen:
- Dissociatie van zouten;
- Water ionisatie;
- Zout hydrolyse.
Dissociatie van zouten
Wanneer een oplosbaar zout aan water wordt toegevoegd, dissocieert het en komt een ander kation dan hydronium (H+) en een ander anion dan hydroxyl (OH-) vrij.

Om u eraan te herinneren wanneer een zout wel of niet oplosbaar is in water, Klik hier en bestudeer de zoutoplosbaarheidstabel.
water ionisatie
Water is een stof die van nature het fenomeen van zelfionisatie ondergaat, dat wil zeggen dat het een hydroniumkation en een hydroxylanion produceert.
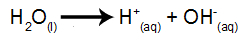
water ionisatie vergelijking:
hydrolyse van een zout
Als oplosbaar zout geeft het ionen vrij in het water en het water ondergaat ionisatie, waardoor ionen in het midden kan de reactie (hydrolyse) tussen de zoutionen en de waterionen plaatsvinden. Wanneer deze reactie optreedt, zijn de mogelijke interacties:
- Kation van het zout met het anion van water (vorming van een base);
- Anion van zout met het kation van water (vorming van een zout);
De bovenstaande interacties zullen alleen optreden als de gevormde base of het zuur zwak is.
Niet stoppen nu... Er is meer na de reclame ;)
Zie een voorbeeld van de hydrolyse van een zout:
→ Hydrolyse van ammoniumhypochloriet (NH4ClO)
Wanneer ammoniumhypochloriet aan water wordt toegevoegd, lost het op en dissocieert het, waarbij de ammoniumkation-ionen (NH4+) en het hypochlorietanion (ClO-) vrijkomen:

Vergelijking met de ionen die vrijkomen bij de dissociatie van ammoniumhypochloriet
Omdat water, wanneer het ionisatie ondergaat, H+ en OH- produceert, hebben we in de oplossing twee kationen en twee anionen, die kunnen reageren. Het NH4+-kation reageert alleen met het OH-anion omdat het een zwakke base (NH4OH) vormt. Het ClO-anion reageert alleen met het H+-kation omdat het een zwak zuur (HClO) vormt.

Ammoniumhypochloriet hydrolyse evenwichtsvergelijking
Constructie van de uitdrukking van de hydrolyseconstante
De constructie van de hydrolyseconstante van een zout hangt uitsluitend af van de hydrolysevergelijking voor dat zout. De hydrolyse van bijvoorbeeld ammoniumhypochloriet, waaraan in het vorige item is gewerkt, leverde de volgende vergelijking op:

Ammoniumhypochloriet hydrolyse evenwichtsvergelijking
Hoe de uitdrukking van build te bouwen hydrolyse constante rekening houdt met producten en reagentia, zou de uitdrukking van de constante zijn:
Kh = [HClO].[NH4OH]
[ClO-].[NH4+]
OPMERKING: Water neemt niet deel aan de vergelijking omdat het een vloeibaar reagens is en ook omdat het het fundamentele middel is voor het optreden van hydrolyse, dat wil zeggen dat het constant is.
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Wat is een hydrolyseconstante?"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm. Betreden op 28 juni 2021.
Wat is scheikunde?

Begrijp wat Kp is, de evenwichtsconstante in termen van druk, en weet hoe je deze kunt verkrijgen door drukken te gebruiken partiëlen van alle gassen die aanwezig zijn in een chemisch evenwicht, dat kan in atmosfeer (atm) of millimeter kwik zijn (mmHg). Klik hier en kom meer te weten over dit onderwerp!
Chemie

Test je kennis en leer meer met deze lijst met opgeloste oefeningen over chemische balansen. Door dit materiaal zul je beter kunnen begrijpen hoe je evenwichtsconstanten (Kp, Kc en Ki), evenwichtsverschuiving, pH en pOH, evenals evenwicht in zogenaamde bufferoplossingen kunt bewerken.