Sinds de oudheid is de mens geïnteresseerd in het beantwoorden van de vraag over de samenstelling van materie.
Verschillende persoonlijkheden uit de wetenschappelijke gemeenschap namen een standpunt in over het onderwerp, maar pas aan het einde van de 19e eeuw begonnen de mysteries over de atomaire samenstelling te worden ontrafeld.
De oude filosoof Leucippus geloofde bijvoorbeeld dat het atoom uit kleine deeltjes bestond.
Na deze definitie werd door Democritus en Dalton voorgesteld dat atomaire deeltjes massief en ondeelbaar waren.
Dit feit werd later betwist door Thomson, een Engelse natuurkundige die het bestaan van het elektron ontdekte en vervolgens het idee dat eerder door Leucipo was voorgesteld, kon bevestigen.
Na deze ontdekking presenteerde Thomson een model waarin het atoom werd gevormd door een bol van positieve ladingen en in de kern zaten elektronen.
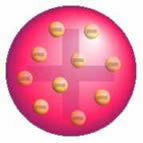
Thomson's Atom Model - In een positief geladen, uniform verdeelde massabol,
ze zouden worden bedekt met negatief geladen elektronen, zoals in een pudding.
Zelfs na de theorie van Thomson had het atoommodel nog steeds een theoretisch-experimenteel gebrek, dat in staat was zijn waarachtigheid te bewijzen.
Het onderwerp werd opnieuw warm besproken toen het team van natuurkundige Rutherford opmerkte dat er een zeer grote afwijking (en onverklaarbaar, volgens de rozijnenpuddingtheorie) toen sommige radioactieve alfadeeltjes door een dunne laag lamina gingen metalen.
Na het feit te hebben geanalyseerd en bestudeerd, kwam Rutherford tot de conclusie dat de straal van het atoom 10.000 keer groter is dan de straal van de kern.
Tijdens de hele studie van het atoom kwamen Rutherford en zijn team in 1911 tot een atoommodel, dat ze het planetaire model van het atoom noemden.

In 1913 ontcijferde Niels Bohr het atoommodel en paste hij het door Planck ontdekte kwantum van actie toe op zijn studies. Het kwantum van actie was in feite het grote jokerteken dat zou komen om het atomaire model te vervolledigen en te verduidelijken.
Bohr heeft het door Rutherford gepresenteerde model efficiënt en eenvoudig aangepast en kwam tot de volgende conclusie:
Het elektron verwerft energie, die wordt weergegeven door een gedefinieerde baan. De toegestane banen vormen de energieniveaus.

Door Talita A. engelen
Afgestudeerd in natuurkunde
Brazilië School Team
Fysica Modern - Fysica - Brazilië School
Bron: Brazilië School - https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm



