Hydrogenering vindt plaats met onverzadigde acyclische koolwaterstoffen, dat wil zeggen die open ketens hebben met dubbele of driedubbele bindingen, zoals alkenen, alkynen en dienen. Het kan ook voorkomen in aromatische koolwaterstoffen, omdat ze dubbele bindingen in de ring hebben, en met cyclanen (cycloalkanen) van maximaal vijf koolstofatomen.
Deze verbindingen reageren als waterstofgas in aanwezigheid van een katalysator, zoals nikkel, platina en palladium, onder verwarming. Er vindt dus een additiereactie plaats, waarbij de pi (π) -binding wordt verbroken, waarbij twee nieuwe enkelvoudige bindingen worden gevormd en waterstof in het molecuul wordt geïntroduceerd.
In het algemeen hebben we:
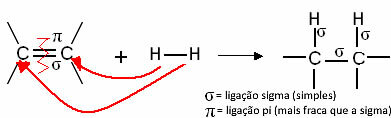
Generieke hydrogeneringsreactie
Laten we nu enkele voorbeelden bekijken:
- Hydrogenering tot alkenen: Het verkregen product is een alkaan.
Hieronder hebben we een hydrogeneringsreactie van ethyleen (of ethyleen) om ethaan te verkrijgen:
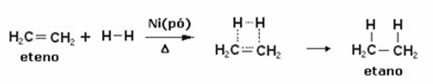
Voorbeeld van een ethyleenhydrogeneringsreactie
Dit type katalytische hydrogenering wordt door de voedingsindustrie gebruikt om halfvaste vetten te maken zoals:
margarines. Plantaardige oliën en vetten verschillen alleen doordat oliën lange moleculen hebben met dubbele bindingen tussen koolstofatomen, terwijl vetten slechts enkele bindingen hebben tussen hun koolstoffen.Dus, om een olie om te zetten in een vet, is het voldoende om de olie te hydrogeneren. Op die manier worden uw dubbele bindingen verbroken en omgezet in enkele bindingen. Het resultaat is de productie van oproepen gehydrogeneerde plantaardige vetten.
- Alkynhydrogenering: Omdat alkynen twee pi-bindingen hebben, vindt hun volledige hydrogenering in twee fasen plaats, in de eerste wordt een alkeen gevormd en in de tweede een alkaan.
In de onderstaande reactie hebben we de hydrogenering van propyn met uiteindelijke vorming van propaan:
1e stap: H3C C ≡ CH+ H2 → H3C CH═ ÇH2
2e etappe: H3C CH═ ÇH2 + twee uur2 → H3C CH2─ ÇH3
Als we willen dat deze reactie in de eerste stap stopt, moeten we een stof gebruiken die de werking van de katalysator stopt.
- Hydrogenering van dienen: Er zijn drie soorten dienen: geaccumuleerd (dubbele bindingen verschijnen hieronder), geïsoleerd (dubbele bindingen worden gescheiden door ten minste twee enkele bindingen) en conjugaten (dubbele bindingen verschijnen afwisselend).
De hydrogenering van geaccumuleerde en geïsoleerde diënen gebeurt op dezelfde manier als we zagen voor alkenen, maar in het dubbele, omdat diënen meer onverzadiging hebben. Zie twee voorbeelden:
* Voorbeeld van hydrogenering in opgehoopt dieen:
H H H
│ │ │
H3C CH ═ Ç ═ CH CH3 + twee uur2 → H3C CH ─ Ç ─ CH CH3
│ │ │
H H H
* Voorbeeld van hydrogenering in geïsoleerd dieen:
H H H H
│ │ │ │
H3C CH ═ CH─CH2 CH ═ CH CH3 +2 H2 → H3C CH ─ CH─CH2 CH ─ CH CH3
Aan de andere kant kan de hydrogenering van geconjugeerde dienen op twee manieren gebeuren: met 1,2-toevoeging en 1,4-toevoeging. De meest voorkomende is de 1,2-additie, waarbij waterstofatomen worden toegevoegd aan koolstoffen die de dubbele binding vormen en bij lage temperaturen. De toevoeging van 1,4 vindt daarentegen plaats bij verhoogde temperaturen en is wanneer er resonantie is en vrije valenties in koolstof 1 en 4 verschijnen. Zie voorbeelden van elk geval:
* Voorbeeld van 1.2 toevoeging in geconjugeerde dienen:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ─ C ─ CH CH2
│ │
H H
* Voorbeeld van toevoeging 1.4 in geconjugeerde dienen:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ═ CH CH2
│ │
H H
- Hydrogenering van aromaten: De pi-bindingen van de benzeenring worden verbroken en de waterstofatomen worden toegevoegd aan de koolstoffen die deze bindingen vormen.
Dit type totale hydrogenering wordt hieronder weergegeven:

Totale benzeenhydrogeneringsreactie:
- Cyclaanhydrogenering: Er vindt vorming van een alkaan plaats.
Voorbeeld: Hydrogenering van cyclopropaan:
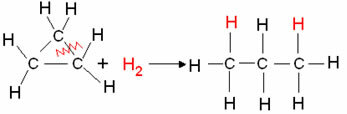
Cyclopropaanhydrogeneringsreactie:
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm

