Ideeën over de samenstelling van materie (het atoom) ontstonden in het oude Griekenland, rond 450 voor Christus. a., voornamelijk afkomstig van Democrito en Leucipo. Het atoom kreeg echter eigenlijk pas een wetenschappelijk karakter na de zogenaamde De atoomtheorie van Dalton.
DE De atoomtheorie van Dalton het was van fundamenteel belang voor de ontwikkeling van atomaire kennis, omdat het als basis diende voor andere wetenschappers om het atoom en zijn kenmerken te kennen.
Wie was John Dalton?
John Dalton, een chemicus van opleiding, werd geboren in Cumbria, Engeland, in 1766 en stierf in Manchester in 1844. Van jongs af aan was zijn leven bestemd voor wetenschappelijk onderzoek en onderwijs, zozeer zelfs dat hij onderwees of bijdroeg aan de ontwikkeling van verschillende kennisgebieden.
Zijn grootste erfenis als wetenschapper was echter de ontwikkeling van de eerste atoomtheorie. Het was door verschillende experimenten met betrekking tot het mengsel van gassen en kennis van de door Lavoisier voorgestelde werken dat de atoomtheorie van Dalton in 1808 naar voren kwam.
Postulaten van de atoomtheorie van Dalton
De atoomtheorie van Dalton was gebaseerd op experimenten, maar geen van deze experimenten kon het atoom duidelijk onthullen. Daarom noemde Dalton het atoom het kleinste deel van de materie.
Daltons theorie biedt veel meer postulaten dan bewijzen. Zie er een paar:
Atomen zijn massief en bolvormig (vergelijkbaar met een biljartbal);
Atomen zijn ondeelbaar;
Atomen zijn onverwoestbaar;
een chemish element het is een verzameling atomen met dezelfde eigenschappen (grootte en massa);
Atomen van verschillende chemische elementen hebben verschillende eigenschappen van elkaar;
Het relatieve gewicht van twee atomen kan worden gebruikt om ze te onderscheiden;
Een samengestelde chemische stof wordt gevormd door dezelfde combinatie van verschillende soorten atomen;
Verschillende chemische stoffen worden gevormd door verschillende atomen te combineren.
Voorstellingen van het Dalton Atomic Model
Dalton noemde zijn atoommodel de biljartbal en begon daarom de atomen van de in zijn tijd bekende elementen weer te geven door middel van bolvormige symbolen.
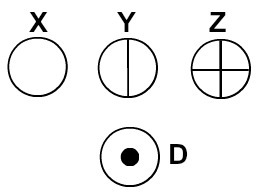
Atomen weergegeven volgens de atoomtheorie van Dalton
Elke atomaire representatie met een specifiek detail geeft een ander chemisch element aan. Didactisch stellen de boeken en oefeningen op het basis- en middenniveau de atomen alleen voor door bollen met verschillende kleuren.
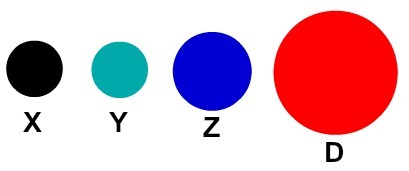
Didactische weergave van atomen
Bijdragen van de atoomtheorie van Dalton
begrip van Wet van behoud van massa van Lavoisierier
De Franse chemicus Lavoisier beweerde in 1785 dat: "in een chemische reactie blijft massa behouden omdat er geen creatie of vernietiging van atomen is" ”. De atoomtheorie van Dalton bewees dit feit, aangezien een van zijn postulaten stelt dat het atoom onverwoestbaar is.
Daarom, als we de verbranding van steenkool (C) uitvoeren in aanwezigheid van zuurstofgas (O2), zullen we een chemische reactie hebben tussen één koolstofatoom en twee zuurstofatomen. Bij deze reactie ontstaat koolstofdioxide (CO2), die precies dezelfde atomen heeft als de stoffen vóór de reactie.
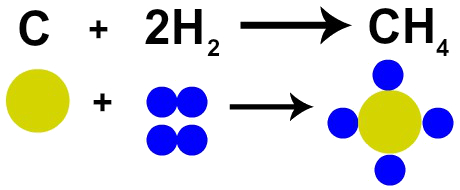
Weergave van de wet van Lavoisier door het atoommodel van Dalton
begrip van eenvoudige stoffen
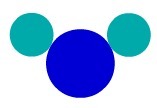
De... gebruiken atoommodel van Dalton, we kunnen een eenvoudige stof begrijpen, dat wil zeggen een stof met atomen van dezelfde eigenschap die een molecuul vormen. Daarom hebben we atomen die tot hetzelfde chemische element behoren.
in wezen F2, we hebben bijvoorbeeld twee fluoratomen, dus we moeten twee soorten gelijke atomen gebruiken in de weergave volgens de atoomtheorie van Dalton.

Eenvoudige substantieweergave volgens according atoommodel van Daltonton
begrip van samengestelde stoffen
In een samengestelde stof hebben we atomen met verschillende kenmerken die het molecuul vormen. Daarom hebben we verschillende chemische elementen die de stof vormen.
Stof H2O heeft bijvoorbeeld drie atomen: twee waterstof en één zuurstof. Zie de weergave ervan volgens het atoommodel van Dalton:
Weergave van een samengestelde stof volgens de huidatoommodel van Daltonton
De mengsels begrijpen
Het begrip van een mengsel (vereniging van twee of meer verschillende stoffen) door de atoomtheorie van Dalton is eenvoudig: plaats gewoon twee verschillende moleculen in dezelfde container.

Vertegenwoordiging van een tweede mengsel atoommodel van Daltonton
Andere wetenschappelijke bijdragen van John Dalton
introduceerde het concept van atoom massa;
Formuleerde de wet van partiële drukken van gassen (Wet van Daltonton);
Ontdekt de visuele beperking genaamd Kleurenblind;
Bestudeerde het gedrag van dampen en gassen bij verschillende temperaturen;
Hij ontdekte dat alle gassen in de ruimte op dezelfde manier uitzetten (ze proberen een bepaalde plaats in te nemen).
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm

