Voor classificeer een sigma-link, het is essentieel om te weten hoe je het kunt herkennen in de structuur van een molecuul. De sigma-binding is eigenlijk een covalente binding die: treedt op wanneer twee onvolledige atomaire orbitalen (met slechts één elektron) doordringen op dezelfde as. Een voorbeeld is wanneer een p-type (helix) orbitaal interpenetreert met een andere p-orbitaal.

p-orbitalen doordringen elkaar in een p-p sigma-binding
In praktijk (bij oefeningen), de herkenning en classificatie van een sigma-link is gemaakt van de structuurformule van een stof, zoals in de onderstaande structuurweergave:

Structuurformule van blauwzuur
Voordat u een sigma-link classificeert, het is noodzakelijk om te weten hoe je het kunt herkennen in een structuurformule. Onthoud hiervoor de manieren zoals een covalente binding is vertegenwoordigd: de oproep gemakkelijk wordt weergegeven door een enkel streepje (-), de paar- wordt weergegeven door twee (=) en de link verdrievoudigen wordt weergegeven door drie (≡). De sigma-binding is als volgt aanwezig in elk van de drie representaties van covalente bindingen:
Gemakkelijk: heeft een sigma-binding;
Paar: Van de twee schakels is er maar één sigma;
Verdrievoudigen: Een van de drie schakels is sigma.
Als u weet hoe u een sigma-link kunt herkennen, is de volgende stap om te leren hoe u deze kunt rangschikken. Hiervoor moeten we weten wat de onvolledige orbitaal is van elk atoom dat bij de binding is betrokken:
H - presenteert de onvolledige s-orbitaal, dus in de classificatie wordt deze weergegeven door s.
Ametalen- een onvolledige p-orbitaal hebben, dus in de classificatie worden ze weergegeven door p, met uitzondering van de volgende elementen:
Koolstof: Uw onvolledige orbitaal hangt af van het type hybridisatie dat hij lijdt. De mogelijkheden zijn: sp hybridisatie3 (hoeveel kost het vier eenvoudige oproepen), sp2 (hoeveel maakt het twee enkele en één dubbele binding) of sp (hoeveel het twee dubbele bindingen uitvoert of een enkele en een drievoudige). Dus in de classificatie van een sigma-binding kan koolstof worden weergegeven door sp3, sp2 of sp, afhankelijk van het gesprek dat u voert.
Beryllium:lijden sp type hybridisatie, dus in de classificatie, wordt weergegeven door sp.
boor:lijden sp type hybridisatie2, dus in de classificatie wordt het weergegeven door sp.2.
Met al deze informatie is het gemakkelijkste om de sigma-links in een structuur te classificeren. Laten we enkele voorbeelden bekijken:
Voorbeeld 1: sigma-verbindingen in water

Structuurformule van water
De structuurformule hierboven laat zien dat water heeft twee sigma-obligaties (twee eenvoudige), zijnde zij tussen de zuurstof (vertegenwoordigd door p) het is de Waterstof (vertegenwoordigd door s). We hebben dus twee sigma-links ingedeeld in:
s-p
Voorbeeld 2: Sigma-bindingen in fosfortrichloride

Structuurformule van fosfortrichloride
De structuurformule hierboven laat zien dat fosfortrichloride heeft: drie oproepensigma's (drie eenvoudig), zijnde zij voer de fosfor in (vertegenwoordigd door p) het is de chloor- (vertegenwoordigd door p). We hebben dus drie sigma-links ingedeeld in:
p-p
Voorbeeld 3: sigma-bindingen in boortrifluoride
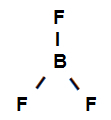
Structuurformule van boortrifluoride
De structuurformule hierboven laat zien dat boortrifluoride heeft: drie sigma-links (drie eenvoudig), zijnde zij ga de boor in (vertegenwoordigd door sp2) het is de Fluor (vertegenwoordigd door p). We hebben dus drie sigma-links ingedeeld in:
p-sp2
Voorbeeld 4: sigma-bindingen in ethanol
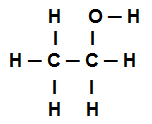
Structuurformule van ethanol
De structuurformule voor ethanol hierboven laat zien dat: we hebben de aanwezigheid van acht oproepen sigma's (acht eenvoudige links). Zijn zij:
Een onder de zuurstof (vertegenwoordigd door p) en de waterstof (vertegenwoordigd door s). De link wordt dus geclassificeerd in sigma s-p.
Een van de twee koolstoffen die alleen sigma-verbindingen uitvoeren (en dan vertegenwoordigd door sp3). De link is dus ingedeeld in: sp3-P3.
Een onder de Carbon (vertegenwoordigd door sp3) en de zuurstof (vertegenwoordigd door p). De sigma-link is dus ingedeeld in: p-sp3.
vijf tussen koolstof (vertegenwoordigd door sp3) en de waterstof (vertegenwoordigd door s). Dus alle vijf zijn ingedeeld in: s-sp3.
Voorbeeld 5: Sigma-bindingen in dichlooretheen

Structuurformule dichlooretheen
De structuurformule van dichlooretheen hierboven laat zien dat we de aanwezigheid hebben van vijf sigma-links (de vier enkele bindingen en één van de dubbele bindingen). Zijn zij:
Een van de twee koolstoffen die twee enkele en één dubbele bindingen uitvoeren (en dan vertegenwoordigd door sp2). De sigma-link is dus ingedeeld in: sp2-P2.
Vier zijn tussen koolstof(vertegenwoordigd door sp2)en de waterstof (vertegenwoordigd door s). Alle vier zijn dus ingedeeld in: s-sp2.
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm

