O smelt- en kookpunt zijn respectievelijk de temperaturen waarbij materialen veranderen van vast naar vloeibaar en van vloeibaar. voor gas of de maximale temperatuur waarbij de vloeistof in een bepaalde fysische toestand kan blijven state druk.
De smelt- en kookpunten van de chemische elementen op het periodiek systeem variëren afhankelijk van hun atoomnummer, wat dan betekent dat het periodieke eigenschappen zijn.
In het periodiek systeem volgt de volgorde van groei van de smelt- en kooktemperaturen van de chemische elementen het volgende pijlenschema:
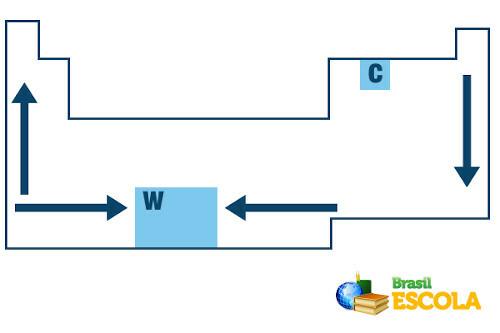
Smelt- en kookpuntgroei in het periodiek systeem
Merk op dat wanneer we de elementen beschouwen die tot dezelfde familie aan de linkerkant van de tabel behoren, de smelt- en kookpunten nemen af naarmate het atoomnummer van het element toeneemt, dat wil zeggen van onder naar omhoog. Dit is te zien aan de smelt- en kookpuntwaarden bij 1 atm voor de hieronder getoonde familie 1-elementen:

Smelt- en kookpunten van familie 1-elementen
Aan de rechterkant van het periodiek systeem gebeurt het tegenovergestelde, de groeirichting van het smelt- en kookpunt van elementen die tot dezelfde familie behoren, neemt van boven naar beneden toe. Daarom staan de elementen met de laagste smelt- en kooktemperaturen bovenaan de tabel. De enige uitzondering is koolstof, dat een smeltpunt heeft van 3550 °C en een kookpunt van 4287 °C.
Niet stoppen nu... Er is meer na de reclame ;)
Anders zijn de meeste met lage smelt- en kookpunten gassen of vloeistoffen bij kamertemperatuur op zeeniveau. Zoals het geval is met edelgassen, stikstof, zuurstof, fluor en chloor, die rechtsboven in de tabel staan.
Nu, als het gaat om elementen die tot dezelfde periode behoren (dezelfde rij in de tabel), zien we dat de smelt- en kookpunten toenemen van de zijkanten naar het midden van de tabel. Zie het voorbeeld voor de elementen van de tweede periode:
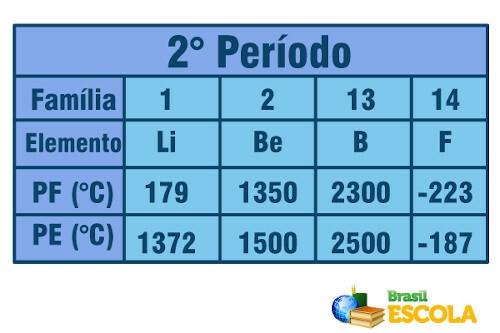
Smeltpunt en kookpunt voor de elementen van de tweede periode van het periodiek systeem
Wolfraam (W) is een element dat zich in het midden van het periodiek systeem bevindt en het smeltpunt is het hoogste van alle metalen, namelijk 3422ºC. Daarom wordt het gebruikt in gloeilampen, omdat het bestand is tegen hoge temperaturen zonder te smelten.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Smelt- en kookpunt - periodieke eigenschappen"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/ponto-fusao-ebulicaopropriedades-periodicas.htm. Betreden op 27 juni 2021.