O benzeen is een organische verbinding geclassificeerd als a aromatische koolwaterstof. Het wordt veel gebruikt als grondstof in de industrie, in laboratoriumprocessen, in staalbedrijven en in de petrochemische industrie voor olieraffinage.
Lees ook: Methaan — de kleinste en eenvoudigste koolwaterstof
Formule
Benzeen is een verbinding met de molecuulformule: Ç6H6en wie heeft een extreem stabiele structuurik. De structuurformule voor benzeen wordt als volgt weergegeven:
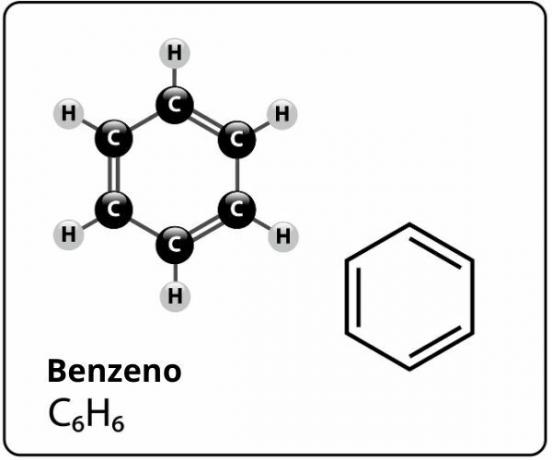
Wie heeft deze structuur voor benzeen voorgesteld met? zes koolstofatomen aan elkaar gebonden met afwisselende dubbele bindingen, een zeshoek vormen en aan elk van hen een atoom van attached hebben bevestigd waterstof, het was de duitse chemicus Friedrich August Kekule, 1866.
Benzeen ondergaat een fenomeen genaamd resonantie, waarin de elektronen in de bindingen tussen de koolstoffen in hun positie verschillen. Om deze reden kan benzeen als volgt worden weergegeven:
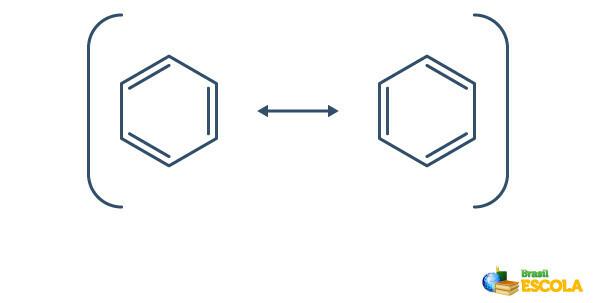
De eigenlijke structuur van benzeen is een intermediair tussen de hierboven getoonde resonantiestructuren. Dit wil niet zeggen dat benzeen soms in de ene vorm voorkomt, soms in een andere, noch dat beide vormen tegelijkertijd bestaan. We stellen benzeen als volgt voor:
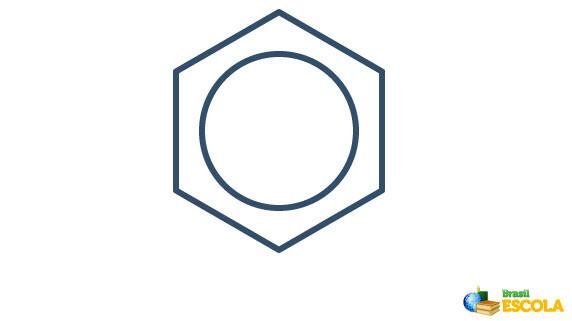
De cirkel binnen de zeshoek vertegenwoordigt de resonantie tussen de elektronen in de bindingen.
Kenmerken
- Benzeen is een vloeistof kleurloos, brandbaar het is gebruikelijk aangenaam aroma karakteristiek.
- Molecuulformule: C6H6.
- Molaire massa: 78,11 g/mol.
- Dichtheid: 0,876 g/cm³.
- Smelttemperatuur: 5,5 °C.
- Kooktemperatuur: 80,1 ºC – de lage kooktemperatuur verklaart de hoge vluchtigheid (gemakkelijk te verdampen).
benzeen is een giftige stof en zijn dampen kunnen duizeligheid, hoofdpijn en flauwvallen veroorzaken.
Lees ook:Koolmonoxide — uiterst giftig, kleurloos en geurloos gas
Toepassingen en toxiciteit van benzeen
benzeen is voornamelijk gebruikt als grondstof in industrieën voor de productie van andere stoffen, zoals kunststoffen en polymeren op basis van styreen, harsen, lijmen, nylon, rubbers, smeermiddelen, pesticiden, enz.
Benzeen is, voornamelijk in laboratoria, vervangen door tolueen, dat polariteit en oplosbaarheid vergelijkbaar met die van benzeen, maar het is minder giftig en heeft een hogere kooktemperatuur.
Benzeen valt binnen de groep van chemische stoffen die als kankerverwekkend worden beschouwd, die bij langdurige blootstelling in hoge concentraties schade aan het beenmerg en leukemie veroorzaken. Op korte termijn kan benzeen duizeligheid, slaperigheid, snelle hartslag, toevallen en flauwvallen veroorzaken.
Omdat het een vluchtige vloeistof is, geeft benzeen gemakkelijk gassen af en daarom vindt verontreiniging met benzeen voornamelijk plaats via de luchtwegen.
Waar wordt benzeen gevonden?
Het meeste benzeen dat in het milieu terechtkomt resultaat van menselijk handelen, voornamelijk bij industriële activiteiten, maar het kan ook vrijkomen als bijproduct van branden en vulkanische activiteiten.
benzeen is een van de bestanddelen van Aardolie en is aanwezig in benzine en komt vrij in de atmosfeer door verbranding van autobrandstoffen. Verder komt het ook voor in frisdranken en sigaretten.

Polariteit
benzeen is een niet-polaire molecule, net als iedereen Koolwaterstoffen en daarom presenteert zeer lage oplosbaarheid in water (0,8 g/L bij 15°C). In sommige laboratoriumprocedures wordt benzeen gebruikt als organisch oplosmiddel voor niet-polaire stoffen.
Nomenclatuur
Er is een regel die alleen wordt toegepast op de nomenclatuur van aromatische verbindingen, dat wil zeggen die met benzeen in hun structuur. Deze regel is verdeeld in twee gevallen, die afhankelijk zijn van de hoeveelheid radicalen die aan de benzeenring zijn bevestigd.
1e GEVAL: wanneer er slechts één radicaal aan de benzeenring is bevestigd, wordt de naam gegeven volgens de volgende regel:
RADICALE NAAM + BENZEEN
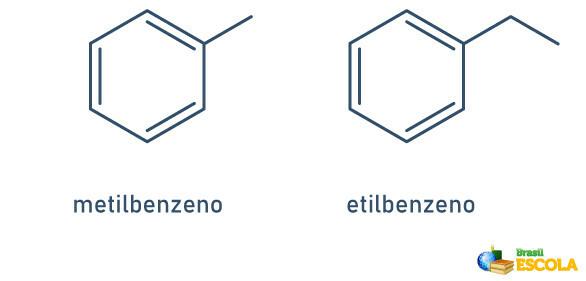
Merk op dat het niet nodig is om de stand van de steel aan te geven.
2e GEVAL: wanneer er meer dan één radicaal aan benzeen is gehecht, volgt de naam de volgende regel:
RADICALE POSITIE + RADICALE NAAM + BENZEEN
Zie het voorbeeld:

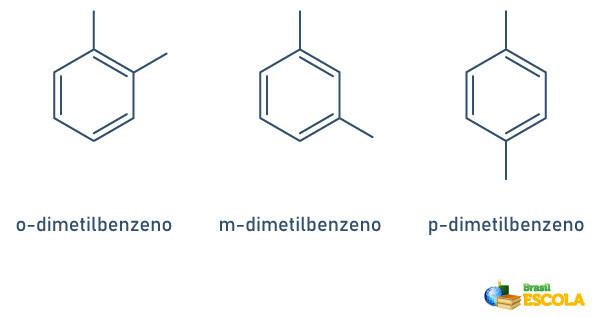
Wanneer de benzeenring slechts twee bevestigde radicalen heeft, is er een specifieke nomenclatuur die kan worden gebruikt:
- 1,2 of ortho(o);
- 1.3 of doel (m);
- 1.4 of tot (p).
Zie de voorbeelden:
Lees ook: Ammoniumnitraat — zeer reactieve verbinding die wordt gebruikt bij de vervaardiging van explosieven
Curiositeiten
- Benzeen is een extreem kankerverwekkende stof, geclassificeerd door het Internationaal Agentschap van Kankeronderzoek, in Groep 1, samen met tabak, dieselrook en vlees verwerkt.
- Er zijn verschillende regelgevende instanties die de blootstelling en uitstoot van benzeen in verschillende landen beperken. In Brazilië is deze rol de verantwoordelijkheid van Anvisa.
- Voordat het de risico's kende, werd benzeen vanwege de aangename geur gebruikt in cosmetica, zoals aftershave.
Door Victor Ricardo Ferreira
Scheikundeleraar



