DE hoekige geometrie is een van de verschillende soorten moleculaire geometrie, die nog steeds lineair, piramidaal, plat trigonaal kan zijn, tetraëdrische, enz. Hoekgeometrie is alleen te vinden in moleculen die de volgende kenmerken hebben:
Triatomics, dat wil zeggen, ze hebben slechts drie atomen;
Hebben ten minste drie elektronenwolken in het centrale atoom.
Opmerking: elektronische cloud is alles covalente binding (enkel, dubbel, drievoudig of coördinaat) tussen atomen en elektronenparen van de valentie laag die niet deelnemen aan een oproep.
Bekijk enkele voorbeelden van moleculen met een hoekige geometrie:
1e voorbeeld: water (H2O)

conventionele waterstructuur
In de structuur van water hebben we:
Drie atomen: twee waterstofatomen en één zuurstof;
Zuurstof is het centrale atoom omdat het een groter aantal bindingen maakt (twee, omdat het tot de VIA-familie behoort);
Twee enkele bindingen tussen zuurstof en waterstofatomen. Dit komt omdat elke waterstof maar één binding kan maken en zuurstof twee bindingen;
Vier niet-bindende elektronen in zuurstof, omdat het zes elektronen in de valentieschil heeft en er slechts twee in de bindingen gebruikt.
Daarom zijn er, net als in het watermolecuul, drie atomen en vier elektronische wolken (twee enkele bindingen en twee niet-bindende elektronenparen) in het centrale atoom, geometrie is hoekig.
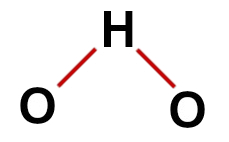
Correcte structuurformule van water
Opmerking: Telkens wanneer het molecuul deze patronen vertoont, is de hoek gevormd tussen de atomen ongeveer 109º 28'.
2e voorbeeld: Zwaveldioxide (SO2)

Conventionele structuur van zwaveldioxide
In de structuur van zwaveldioxide hebben we:
Drie atomen: twee zuurstofatomen en één zwavelatoom;
Zwavel is het centrale atoom omdat het het kleinste element in het molecuul is, omdat alle elementen hetzelfde aantal bindingen moeten maken (twee);
Een dubbele binding tussen zwavel en een van de zuurstofatomen. Dat komt omdat beide twee verbindingen nodig hebben;
een coördinaat of datief covalente binding, omdat de zwavel stabiel was na de koppeling met de andere zuurstof, maar er is nog steeds een zuurstofatoom dat twee elektronen nodig heeft;
Vier niet-bindende elektronen in zuurstof. Dat komt omdat zuurstof zes elektronen in de valentieschil heeft en er slechts twee in de bindingen gebruikt.
Dus, net als in het zwaveldioxidemolecuul, zijn er drie atomen en vier elektronische wolken (twee enkele bindingen en twee paar niet-bindende elektronen) in het centrale atoom, geometrie is hoekig.
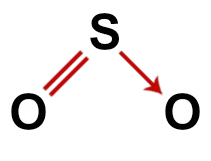
Correcte structuurformule van zwaveldioxide
Opmerking: Telkens wanneer het molecuul deze patronen heeft, is de hoek gevormd tussen de atomen ongeveer 120O.
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm