Een van de grootste uitdagingen voor iedereen die scheikunde leert, wordt elektronische distributie genoemd. Wat we in deze context gaan presenteren, kan je studies met betrekking tot de elektronenconfiguratie voorgesteld door wetenschapper Linus Pauling enorm vergemakkelijken.
Het maximale aantal elektronen dat in elke laag of energieniveau past, wordt gegeven door de tabel:
Energieniveaulaag Maximaal aantal elektronen
1e K 2
2e L 8
3e M 18
4e N 32
5° O 32
6e P 18
7e Q 8
De toenemende volgorde van energie van de subniveaus is de volgorde in de volgorde van de diagonalen. Het Linus Pauling-diagram wordt hieronder weergegeven:
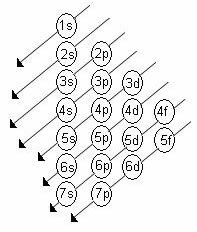
Basisregels:
1. Het atoomnummer (Z) van het element, in de neutrale toestand, geeft het aantal te verdelen elektronen aan. Dit nummer wordt weergegeven in de linkerbenedenhoek van het elementsymbool.
2. Gebruik het Pauling-diagram om de elektronen van boven naar beneden te verdelen, rekening houdend met de toenemende volgorde van energie (gericht door de richting van de pijlen).
3. Vul de subniveaus met het maximale niveau van elektronen. Als een bepaald subniveau slechts 6 elektronen bevat, overschrijd dat aantal dan niet.
4. Controleer het aantal elektronen door ze in elk subniveau op te tellen.
Laten we het in de praktijk brengen?
Verdeel de elektronen van het ijzeratoom (Z=26).
Als het atoomnummer 26 is, betekent dit dat er in het normale ijzeratoom 26 elektronen zijn. Als we het Pauling-diagram toepassen, hebben we:
Niet stoppen nu... Er is meer na de reclame ;)

Door Liria Alves
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Elektronische Distributieregels"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm. Betreden op 27 juni 2021.