Sulfoneringsreacties in alkanen zij zijn organische substitutiereacties, uitgevoerd met het doel om te produceren: sulfonzuren (organische verbindingen die de SO-groep hebben3H gebonden aan een koolstofatoom of aan een koolstofketen) en water (H2O).
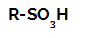
Structuurformule van een sulfonzuur
Voor het uitvoeren van een sulfoneringsreactie op alkanen, moeten we een alkaan (verbinding gevormd door een koolstofketen die verzadigd is met alleen koolstof- en waterstofatomen) en de zwavelzuur (H2ENKEL EN ALLEEN4) geconcentreerd, onderworpen aan verwarming (∆).
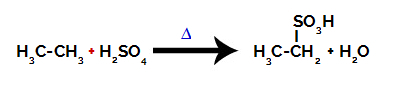
Chemische vergelijking die de sulfonering van een alkaan met twee koolstofatomen weergeeft
Principes van de sulfoneringsreactie in alkanen
Zoals alkaansulfoneringsreactie het is een substitutiereactie, we hebben daarin een uitwisseling tussen kleinere componenten elektronegativiteit van de reactanten, dat wil zeggen tussen alkaan en zwavelzuur. Alkaan heeft waterstof en zwavelzuur, de sulfongroep.
Hieronder hebben we stap voor stap het mechanisme van a
sulfoneringsreactie in alkanen. Als voorbeeld gebruiken we het eenvoudigste alkaan, methaan (CH4):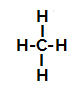
Structuurformule van methaan
1e stap: Verstoring van de binding tussen hydroxyl (OH) en zwavel (S) in zwavelzuur.
Elke hydroxylgroep die aanwezig is in zwavelzuur wordt gekenmerkt doordat hij meer elektronegatief is. Bij verhitting tijdens de reactie bestaat de neiging dat de binding tussen de hydroxylgroep en de zwavel wordt verbroken:
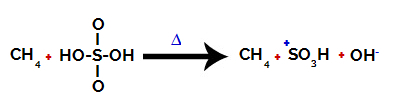
Verstoring van de binding tussen zwavel en hydroxyl
Het verbreken van de binding van alle hydroxylen treedt echter niet op vanwege de elektronische herschikking in de structuur. Er wordt dan een hydroxide-anion (OH) verkregen.-) en een sulfonkation.
2e stap: Hydroxylgroepaanval op het alkaanmolecuul.
Dan is de hydroxygroep (OH-) voert een aanval uit op het alkaan, waardoor de binding tussen koolstof en waterstof (die kwetsbaarder is vanwege het verschil in elektronegativiteit ertussen) wordt verbroken.
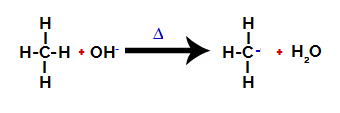
De binding tussen koolstof en waterstof in alkaan verbreken
Opmerking: Verstoring van de binding tussen koolstof en waterstof zal altijd het meest voorkomen op koolstof met een lagere elektronische dichtheid of lading. Hoe minder waterstof koolstof heeft, of hoe meer groepen eraan vastzitten, hoe lager de elektronendichtheid. Dus we hebben:
Tertiaire koolstof < Secundaire koolstof < Primaire koolstof
Nadat de binding is verbroken, wordt het alkaan een elektronenarme koolstof (carbocation). De hydroxidegroep (OH)-) interageert met de vrijgekomen waterstof en vormt een watermolecuul.
3e stap: Aanval van het gevormde radicaal op de sulfongroep.
Ten slotte wordt de sulfongroep aangevallen door de rest van het alkaan, waardoor een sulfonzuur wordt gevormd.
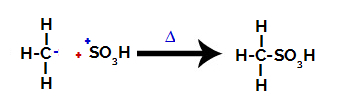
Structuren die op elkaar inwerken en sulfonzuur vormen
Voorbeelden van vergelijkingen die sulfoneringsreacties in alkanen weergeven
1e voorbeeld: Sulfonering van propaan.
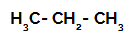
Structuurformule van propaan
Propaan heeft twee primaire koolstoffen en één secundaire koolstof, die verschillende ladingen hebben omdat ze zijn gebonden aan verschillende hoeveelheden waterstof. Omdat koolstof meer elektronegatief is dan waterstof, hebben deze koolstoffen verschillende elektronendichtheden.
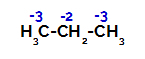
Verdeling van ladingen op elk koolstofatoom van propaan
Op primaire koolstoffen is de lading -3 (omdat deze is gebonden aan drie waterstofatomen), en op de secundaire koolstof is de lading -2 (omdat deze is gebonden aan twee waterstofatomen). Er zal dus een breuk optreden in de binding tussen koolstof en waterstof, soms bij koolstof 1 (van het ene molecuul), soms bij koolstof 2 (van een ander molecuul).
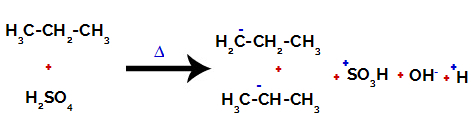
De binding tussen koolstof en waterstof op verschillende koolstofatomen verbreken
Na de breuken tussen de bindingen, zowel in zwavelzuur als in alkaan, is er de vorming van producten met de vervanging van waterstof op koolstof 1 door een sulfongroep, en hetzelfde gebeurt op koolstof 2.
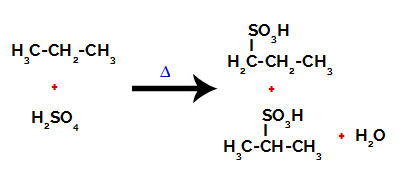
Producten gevormd uit de sulfonering van propaan
2e voorbeeld: Sulfonering van 2-methylbutaan.

Structuurformule van 2-methylbutaan
2-Methyl-butaan heeft drie primaire koolstoffen, een secundaire koolstof en een tertiaire koolstof, die: verschillende ladingen en bijgevolg verschillende elektronische dichtheden, zoals te zien is in de volgende structuur:
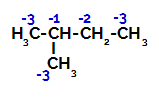
Verdeling van elektronische ladingen in 2-methylbutaan
Daarom zijn er in 2-methylbutaan verschillende mogelijkheden om de binding tussen koolstof en waterstof te verbreken, die kan voorkomen op koolstof 1 (van een molecuul), koolstof 2 (van een ander molecuul), koolstof 3 of koolstof 4. Het is echter opmerkelijk dat de verstoring bij koolstof nummer 2 vaker voorkomt.
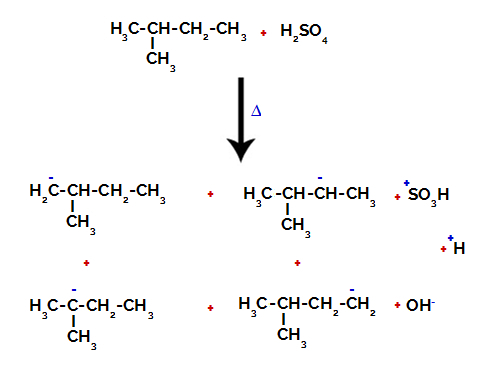
De binding tussen koolstof en waterstof op verschillende koolstofatomen verbreken
Na de breuk tussen de bindingen, zowel in zwavelzuur als in alkaan, ontstaat producten met de vervanging van de waterstof op koolstof 1 door een sulfongroep, en hetzelfde gebeurt op de koolstof 2.

Producten gevormd door de sulfonering van 2-methylbutaan
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm
