Covalente bindingen kunnen voorkomen in moleculaire of datieve en coördinaatvorm.
Moleculaire covalente binding
In deze binding zijn de atomen verbonden vanwege het delen van hun elektronen, dan verschijnen de elektronische paren aangegeven door de cirkel:
Moleculaire covalente binding van twee chloor (Cl) atomen.
Elk gelijktijdig gevormd elektronisch paar behoort tot de twee atomen. Moleculen zijn elektrisch neutrale structuren omdat er geen winst of verlies van elektronen is, alleen delen.
Water is een moleculaire verbinding die bestaat uit twee waterstofatomen (H2) en één zuurstof (O).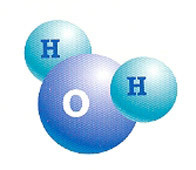
datieve en coördinaat covalente binding
Deze binding voldoet aan de Octet-theorie: Atomen verenigen zich in een poging acht elektronen te verwerven in de valentieschil, dat wil zeggen de elektronische configuratie van de edelgassen.
Dus een atoom dat al elektronische stabiliteit heeft bereikt, voegt zich bij een ander dat elektronen nodig heeft om de valentieschil te voltooien. Een voorbeeld van deze binding is wanneer een zwavelatoom bindt met twee zuurstofatomen om zwaveldioxide te vormen (SO
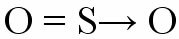
Het zwavelatoom (S) krijgt zijn octet met de vorming van een dubbele binding met de zuurstof aan de linkerkant (gecoördineerde binding), maar tegelijkertijd heeft de zuurstof aan de rechterkant elektronen nodig om zijn octet. Dan verschijnt de datief covalente binding vertegenwoordigd door een kleine vector (pijl). De pijl geeft aan dat de “zo” doneert een elektronenpaar aan de “O”.
Laten we eens kijken naar het delen van elektronen bij de vorming van de zwaveltrioxideverbinding (SO3).
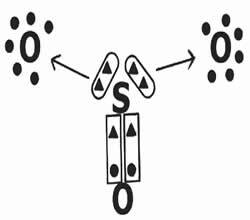
Merk op dat het centrale element (zwavel) een dubbele binding (gecoördineerd) tot stand brengt met een van de zuurstofatomen, waardoor elektronische stabiliteit wordt bereikt (acht elektronen in de valentieschil). Aan de andere kant doneert het twee elektronenparen aan de zuurstofatomen (datieve binding aangegeven door de pijl →) in een poging het octet te voltooien.
Door Liria Alves
Afgestudeerd in scheikunde
Bekijk meer!
Metalen verbinding
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/ligacao-covalente.htm


