Er zijn drie soorten alkadiënen of dienen, namelijk:
1-Gecumuleerd: De dubbele bindingen bevinden zich op dezelfde koolstof en verschijnen achtereenvolgens:
C ═ Ç ═ C
│ │
2- Geïsoleerd: De dubbele bindingen zijn op verschillende koolstofatomen en worden gescheiden door ten minste twee opeenvolgende enkele bindingen:
│
C ═ C C ─ C ═ C
│ │ │ │ │
3- Conjugaten: Dubbele bindingen verschijnen afwisselend, gescheiden door een enkele binding:
C ═ C C ═ C
│ │ │ │
Een voorbeeld van een belangrijk geconjugeerd dieen is isopreen, dat een basiseenheid is van de terpeengroep, een klasse van organische verbindingen. zeer belangrijk, enkele voorbeelden van producten gevormd door isoprenen zijn rubber, bètacaroteen (verantwoordelijk voor de oranje kleur van de wortelen), vitamine A en oliën in fruitschillen, zaden, bloemen, bladeren, wortels, groenten en hout, zoals limoneen en myrceen.
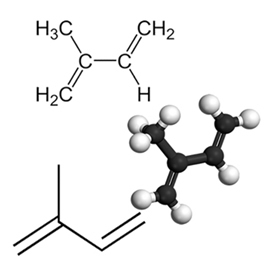
Naar de geaccumuleerde en geïsoleerde diënen, er treden additiereacties op net als in het geval van alkenen, wat u kunt begrijpen door de tekst te lezen
Toevoegingsreacties. Het enige verschil is dat diënen dit type dubbele reactie ondergaan, omdat ze twee dubbele bindingen hebben, terwijl alkenen slechts één dubbele binding hebben.Echter, in het geval van geconjugeerde diënen, de additiereactie heeft een eigenaardigheid, omdat deze verbindingen resonantie kunnen ondergaan, dus de toevoeging kan op twee manieren plaatsvinden:
1- Toevoeging 1.2:
Dit wordt als normale toevoeging beschouwd, omdat de toevoeging plaatsvindt op de twee koolstofatomen die dezelfde dubbele binding maken, dat wil zeggen op koolstofatomen 1 en 2:
H2Ç ═ CH─ CH ═ CH2 + HBr → H2C CH─ CH ═ CH2
│ │
HBr
Zie dat dit type reactie volgt op de Regel van Markovnikov, de waterstofbindingen aan de meer gehydrogeneerde koolstof (met meer waterstofatomen eraan).
Toevoeging 1,2 wordt verwerkt bij lage temperaturen (-60°C).
2- Toevoeging 1.4:
In dit geval verloopt de reactie bij hoge temperaturen. Het is belangrijk om te benadrukken dat zowel het product van toevoeging 1.2 als toevoeging van 1.4 altijd worden gevormd, maar de temperatuur geeft aan welke in grotere hoeveelheid zal worden gevormd.
Het volgende is een voorbeeld van toevoeging van type 1.4:
H2Ç ═ CH─ CH ═ CH2 + HBr → H2C CH ═ CH─CH2
│ │
HBr
Merk op dat het volgende gebeurt, een van de gedeelde elektronen in de pi-binding van elk van de dubbele koolstofatomen: worden gedeeld met de substituent en de anderen vormen een nieuwe dubbele binding tussen andere koolstoffen:
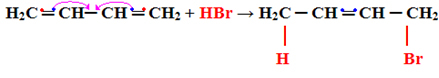
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/reacoes-adicao-dienos.htm

