we hebben een mengen van oplossingen met verschillende opgeloste stoffen zonder chemische reactie wanneer twee of meer mengsels die stoffen met hetzelfde ion gemeen hebben (hetzij hetzelfde kation of hetzelfde anion). Zoals in het onderstaande voorbeeld:
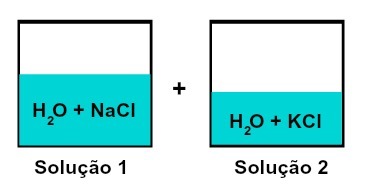
Mengsel van oplossingen met verschillende opgeloste stoffen
Oplossing 1 is water en natriumchloride (NaCl), terwijl oplossing 2 water en kaliumchloride (KCl) bevat. Bij elkaar gemengd hebben we een mengen van verschillende opgeloste oplossingen zonder chemische reactie, omdat beide gebruikte zouten het chloride-anion (Cik-).
1- Kenmerken van mengsels van verschillende opgeloste oplossingen zonder chemische reactie
Wanneer een mengsel van oplossingen met verschillende opgeloste stoffen zonder chemische reactie wordt uitgevoerd, worden de onderstaande kenmerken altijd gecontroleerd:
De massa van elk van de opgeloste stoffen verandert niet (als we in oplossing 1 10 g opgeloste stof hebben en in 2, 30 g, bijvoorbeeld, na het mengen hebben we dezelfde massa van elke opgeloste stof),
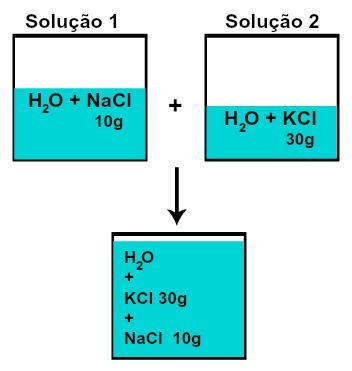
Massa van elk van de opgeloste stoffen na het mengen van oplossingen zonder chemische reactie
DE hoeveelheid materie (n) van elk van de opgeloste stoffen verandert niet (als we in oplossing 1 5 mol opgeloste stof hebben en in 2, 4 mol, bijvoorbeeld, na het mengen hebben we dezelfde hoeveelheid materie van elk),
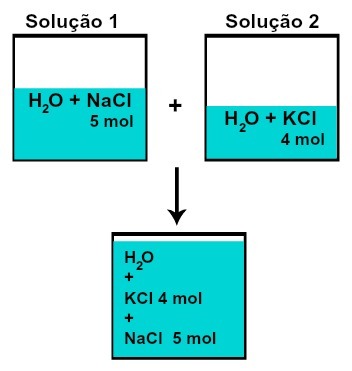
Aantal mol van elk van de opgeloste stoffen na het mengen van oplossingen zonder chemische reactie
Het volume van de uiteindelijke oplossing, VF, is het resultaat van de som van de volumes van elk van de gemengde oplossingen (als we in oplossing 1 200 ml hebben en in oplossing 2 bijvoorbeeld 300 ml, na het mengen hebben we 500 ml volume),
VF = V1 + V2
2- Formules die worden gebruikt bij berekeningen van het mengen van oplossingen van verschillende opgeloste stoffen zonder chemische reactie.
Zoals bij dit type mengsel hebben we alleen een toename van de hoeveelheid oplosmiddel in verhouding tot elk van de opgeloste stoffen, moeten we de eindconcentratie van elk van de opgeloste stoffen berekenen met behulp van het volgende: uitdrukkingen:
a) Om gemeenschappelijke concentratie (Ç)
Voor oplossing 1: de vermenigvuldiging van de concentratie van oplossing 1 met het volume is gelijk aan de eindconcentratie vermenigvuldigd met het volume
Ç1.V1 = CF.VF
Voor oplossing 2: de vermenigvuldiging van de concentratie van oplossing 2 met het volume is gelijk aan de eindconcentratie vermenigvuldigd met het volume
Ç2.V2 = CF.VF
b) Om concentratie in hoeveelheid materie of molariteit (M)
Voor oplossing 1:
M1.V1 = MF.VF
Voor oplossing 2:
M2.V2 = MF.VF
c) Concentratie in hoeveelheid materie van elk ion aanwezig in de oplossing
Als we de concentratie van een of alle ionen in de uiteindelijke oplossing moeten bepalen, moeten we:
1º: Onthoud dat de ionenconcentratie wordt gegeven door de vermenigvuldiging van de concentratie (M), van de opgeloste stof waarvan het afkomstig is, door de index in de stofformule. Dus voor het ion Y, in substantie 1, XY3, zal de concentratie zijn:
[J]1 = 3. M
Wat betreft opgeloste stof2, ZY, zou de concentratie van Y worden gegeven door:
[J]2 = 1. M
2º: Als we meer dan één opgeloste stof hebben die hetzelfde ion afgeeft, bijvoorbeeld de XY opgeloste stoffen3 en ZY, die hetzelfde ion Y hebben, wordt de concentratie van dit ion in de uiteindelijke oplossing gegeven door de som van de concentraties voor elke opgeloste stof:
[J]F = [J]1 + [J]2
3- Voorbeelden van berekeningen waarbij oplossingen van verschillende opgeloste stoffen worden gemengd zonder chemische reactie
Voorbeeld 1: (PUC SP) In een bekerglas werd 200 ml van een waterige oplossing van calciumchloride (CaCl) gemengd2) met een concentratie van 0,5 mol. L–1 en 300 ml van een 0,8 mol oplossing. L–1 natriumchloride (NaCl). De verkregen oplossing heeft een chloride-anionconcentratie van ongeveer:
a) 0,34 mol. L–1
b) 0,65 mol. L–1
c) 0,68 mol. L–1
d) 0,88 mol. L–1
e) 1,3 mol. L–1
De door de oefening verstrekte gegevens waren:
Oplossing 1:
Volume (V1): 200 ml
Molaire concentratie (M1): 0,5 mol. L–1
Oplossing 2:
Volume (V2): 300 ml
Molaire concentratie (M2): 0,8 mol. L–1
Om de concentratie van chloride-anionen (Cl-), moeten we deze stappen volgen:
Stap 1: bereken het volume van de uiteindelijke oplossing
VF = V1 + V2
VF = 200 + 300
VF = 500 ml
Stap 2: Bereken de molaire concentratie van de uiteindelijke oplossing met betrekking tot de CaCl-opgeloste stof2, met behulp van de onderstaande uitdrukking:
M1.V1 = MF.VF
0,5.200 = MF.500
100 = MF.500
100 = MF
500
MF = 0,2 mol. L–1
Stap 3: Bereken de molaire concentratie van chloride[Cl-]1, in de uiteindelijke oplossing, van de CaCl-opgeloste2, met behulp van de onderstaande uitdrukking:
OPMERKING: In de formule hebben we de vermenigvuldiging van molariteit met 2 omdat we index 2 hebben in Cl, in de opgeloste formule CaCl2.
[Cl-]1 = 2.MF
[Cl-]1 = 2. 0,2
[Cl-]1 = 0,4 mol. L–1
Stap 4: Bereken de molaire concentratie van de uiteindelijke oplossing met betrekking tot de NaCl-opgeloste stof, met behulp van de onderstaande uitdrukking:
M2.V2 = MF.VF
0,8.300 = MF.500
240 = MF.500
240 = MF
500
MF = 0,48 mol. L–1
Stap 5: Bereken de molaire concentratie van chloride, [Cl-]2, in de uiteindelijke oplossing, van de NaCl-opgeloste stof, met behulp van de onderstaande uitdrukking:
OPMERKING: In de formule hebben we de vermenigvuldiging van molariteit met 1 omdat we index 1 hebben in Cl, in de formule voor de opgeloste stof NaCl.
[Cl-]2 = 1.MF
[Cl-]2 = 1. 0,48
[Cl-]2 = 0,48 mol. L–1
Stap 6: Bereken de totale hoeveelheid chloride-ionen in de uiteindelijke oplossing
Om dit te doen, voegt u gewoon de molaire concentraties van chloriden toe voor elk van de opgeloste stoffen in stap 3 en 5:
[Cl-]F = [Cl-]1+ [Cl-]2
[Cl-]F = 0,4 + 0,48
[Cl-]F = 0,88 mol. L–1
Voorbeeld 2: Aan een oplossing van 500 ml 6 mol/L KOH werd 300 ml K-oplossing toegevoegd.2ENKEL EN ALLEEN3 3mol/L. Wat is de concentratie van elk van de opgeloste stoffen in het resulterende mengsel?
a) 3,75 en 3,0 mol/L
b) 3,75 en 1,215 mol/L
c) 4,5 en 1,125 mol/L
d) 3,75 en 1,125 mol/L
e) 4,5 en 1,215 mol/L
De door de oefening verstrekte gegevens waren:
Oplossing 1:
Volume (V1): 500 ml
Molaire concentratie (M1): 6mol. L–1
Oplossing 2:
Volume (V2): 300 ml
Molaire concentratie (M2): 3mol. L–1
Om de concentratie van chloride-anionen (Cl-), moeten we deze stappen volgen:
Stap 1: bereken het volume van de uiteindelijke oplossing
VF = V1 + V2
VF = 500 + 300
VF = 800 ml
Stap 2: Bereken de molaire concentratie van de uiteindelijke oplossing met betrekking tot de KOH opgeloste stof, met behulp van de onderstaande uitdrukking:
M1.V1 = MF.VF
6.500 = MF.800
3000 = MF.800
3000 = MF
800
MF = 3,75 mol. L–1
Stap 3: Bereken de molaire concentratie van de uiteindelijke oplossing in relatie tot opgeloste stof K2ENKEL EN ALLEEN3, met behulp van de onderstaande uitdrukking:
M2.V2 = MF.VF
3.300 = MF.800
900 = MF.800
900 = MF
800
MF = 1,125 mol. L–1
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm
