In de toevoeging reactiesin alkenen(koolwaterstoffen die een dubbele binding hebben tussen twee koolstofatomen), een pi-binding tussen twee koolstofatomen wordt verbroken en elk van de koolstofatomen hecht zich aan een nieuw atoom. Kijken:
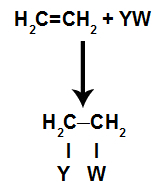
Algemeen schematisch model van een additiereactie
Principes van een additiereactie
a) Breuk van pi-link
Een pi-binding wordt gemakkelijk verbroken omdat het een zwakkere binding is dan een sigma-binding. Om dit te laten gebeuren, is het echter noodzakelijk dat het alkeen wordt onderworpen aan omstandigheden die voor deze verstoring zorgen. Na het verbreken van de pi-binding tussen twee koolstofatomen, verschijnt er altijd een bindingsplaats (voor nieuwe atomen) op elk van de betrokken koolstoffen.
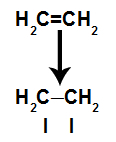
Schematische weergave van pi-linkbreuk
b) Voorwaarden voor het verbreken van een pi-binding
De factoren die het verbreken van een pi-binding bevorderen zijn:
Gebruik van katalysatoren;
Verwarming;
Aanwezigheid van een zuur in het reactiemedium.
c) Het optreden van de additiereactie
De bindingsplaatsen die worden gecreëerd nadat de pi-binding is verbroken, zullen altijd worden ingenomen door atomen van de reactant die zich in dezelfde container als het alkeen bevindt. De additiereactie is genoemd naar het type reagens dat met het alkeen is gemengd.
Soorten toevoegingsreacties in alkenen
a) Hydrogenering
Een alkeen wordt gemengd met waterstofgas (H2) in een houder en onderworpen aan de werking van een vaste katalysator (nikkel, platina of palladium) en verwarming (Δ).
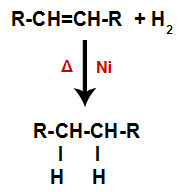
Algemeen schema van een hydrogeneringsreactie in alkenen
De aanwezigheid van de katalysator en verwarming veroorzaken de pi-binding van alkeen en de sigma-binding tussen de waterstofatomen van H2 sneller kapot gaan. Daarmee hebben we de vorming van twee bindingsplaatsen in het alkeen en twee vrije waterstofatomen in het reactiemedium.

Creatie van atoombindings- en scheidingsplaatsen
Dus onmiddellijk daarna bezet elk vrij waterstofatoom een van de bindingsplaatsen die in het alkeen zijn gevormd. Omdat de gevormde stof alleen koolstoffen en waterstofatomen heeft, evenals alleen eenvoudige bindingen tussen de koolstoffen, is het een alkaan.
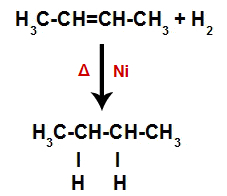
Vergelijking die de vorming van alkaan bij hydrogenering weergeeft
B) Halogenatie
Een alkeen wordt gemengd met eenvoudige stoffen (F2, Cl2, br2 Hallo2) gevormd door halogenen (chloor, fluor, jodium en broom) in een container en onderworpen aan de werking van licht (λ) en verwarming (Δ).

Algemeen schema van een halogeneringsreactie in alkenen
Door de werking van licht en verwarming worden de pi-binding van het alkeen en de sigma-binding tussen stoffen gevormd door halogeen sneller verbroken. Hiermee hebben we de vorming van twee bindingsplaatsen in het alkeen en twee vrije halogeenatomen in het reactiemedium.

Creatie van atoombindings- en scheidingsplaatsen
Dus onmiddellijk daarna bezet elk vrij halogeenatoom een van de bindingsplaatsen die in het alkeen zijn gevormd. Omdat de gevormde stof halogeen heeft dat is gekoppeld aan een structuur die bestaat uit koolstoffen en waterstofatomen, is het een organisch halide.

Vergelijking die de vorming van organisch halogenide bij halogenering weergeeft
c) Hydratatie
Een alkeen wordt gemengd met water (H2O) in een container en onderworpen aan de werking van een katalysator (in dit geval zwavelzuur).
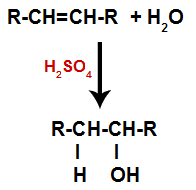
Algemeen schema van een hydratatiereactie in alkenen
De aanwezigheid van zwavelzuur in de reactie zorgt ervoor dat de pi-binding van alkeen en de sigma-binding tussen waterstof (H) en hydroxyl (OH) van water sneller breken. Daarmee hebben we de vorming van twee bindingsplaatsen in het alkeen en een vrije waterstof en een hydroxyl in het reactiemedium.
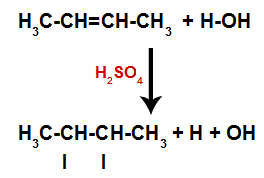
Creatie van atoombindings- en scheidingsplaatsen
Zo bezetten kort daarna waterstof en hydroxyl een van de in het alkeen gevormde bindingsplaatsen. Omdat de gevormde stof hydroxyl heeft gebonden aan een verzadigde koolstof (het maakt alleen eenvoudige bindingen), is het een alcohol.
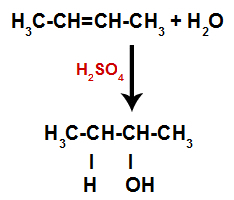
Vergelijking die de vorming van alcohol bij hydratatie weergeeft
d) Toevoeging met waterstofhalogeniden
Een alkeen wordt in een container gemengd met een gehalogeneerd anorganisch zuur (HF, HI, HCl, HBr).

Algemeen schema van een zuurhalogenidereactie in alkenen
De aanwezigheid van zuur in de reactie zorgt ervoor dat de pi-binding van het alkeen sneller breekt. De enkele binding in het zuur wordt verbroken omdat deze stoffen van nature ioniseren. Zo worden twee bindingsplaatsen gecreëerd in het alkeen en is er de aanwezigheid van een vrije waterstof en een halogeen in het reactiemedium.
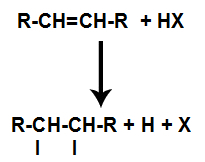
Creatie van atoombindings- en scheidingsplaatsen
Zo bezetten kort daarna waterstof en halogeen een van de in het alkeen gevormde bindingsplaatsen. Omdat de gevormde stof halogeen heeft gekoppeld aan een structuur die bestaat uit koolstoffen en waterstofatomen, is het een organisch halide.
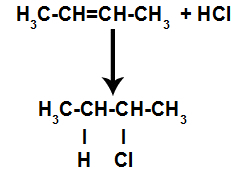
Vergelijking die de vorming van organisch halogenide bij halogenering weergeeft
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm
