Een oplossing is een homogeen mengsel van twee of meer stoffen.. Zoals bijvoorbeeld een oplossing van zout (opgeloste stof) opgelost in water (oplosmiddel).

Vooral in chemische laboratoria en industrieën is dit proces erg belangrijk, omdat de chemicus oplossingen met bekende concentraties moet bereiden. Verder worden bij experimentele activiteiten oplossingen met zeer lage concentraties gebruikt, dus een monster van de geconcentreerde oplossing wordt verdund tot de gewenste concentratie.
Dagelijks, meerdere keren, zonder het te beseffen, voeren we het proces van het verdunnen van oplossingen uit. Zo adviseert de verpakking van schoonmaak- en huishoudelijke hygiëneproducten, zoals desinfectiemiddelen, deze voor gebruik te verdunnen. Sommige fabrikanten suggereren op productetiketten dat het moet worden verdund met water in een verhouding van 1 tot 3, dat wil zeggen dat voor elk deel van het product 3 delen water moeten worden toegevoegd. Dit wordt gedaan omdat het product zeer geconcentreerd en sterk is en de plaats waar het zal worden aangebracht kan beschadigen als het niet op de juiste manier wordt verdund. Aan de andere kant, als u het meer verdunt dan zou moeten, kunt u geld verliezen, omdat het product niet het gewenste resultaat zal bereiken.

Een ander voorbeeld is wanneer we sappen maken. Op de etiketten van veel sapconcentraten staat dat een glas sap verdund of gemengd moet worden met 5 glazen water. Het sap is dus "zwakker", dat wil zeggen minder geconcentreerd.
Stel je voor dat je zo'n sap hebt verdund in 3 L water. Als de aanvankelijke sapconcentratie 40 g/L was, betekent dit dat het een massa van 40 g had voor elke liter oplosmiddel. Maar aangezien we 3 L hebben, wordt de massa gedeeld door 3 en is de concentratie dan ongeveer 13, 33 g/L of 13 gram voor elke liter oplossing. In de hele oplossing blijft echter de massa van de 40 g opgeloste stof over.
De berekening van deze nieuwe concentratie kan als volgt worden gedaan:
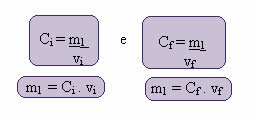
Waarbij de indexen i en f respectievelijk de begin- en eindwaarden vertegenwoordigen. Aangezien de waarde van m1 niet is veranderd, kunnen we de vergelijkingen gelijkmaken:
Çik. vik = Cf. vf
Vervang de waarden die we hebben, volgens het vorige voorbeeld, let op:
Eerste oplossing:
Çik: 40g/L
m1: 40g
vik: 1L
Uiteindelijke oplossing:
Çf: ?
m1: 40g
vf: 3L
Çik. vik = Cf. vf
(40 g/l). (1 L) = Cf. 3L
Çf = 40 g/L
3
Çf = 13,333 g/L
Dezelfde redenering geldt ook voor de molaire concentratie (M) en voor het massapercentage opgeloste stof of titer (T):
Mik. vik = Mf. vf en Tik. vik = Tf. vf
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Brazilië School Team
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm
