DE elektronegativiteit het is de neiging van een atoom om elektronen naar zich toe te trekken wanneer het is gekoppeld aan een ander chemisch element. door een covalente binding, dat wil zeggen, waarin elektronen worden gedeeld, gezien dit molecuul als zijnde geïsoleerd.
Laten we twee voorbeelden bekijken om het gepresenteerde concept beter te begrijpen:
1e voorbeeld: Waterstofgasmolecuul: H2 → H - H
Wanneer twee waterstofatomen samenkomen, treden de aantrekkingskrachten tussen de kernen van elk tegelijkertijd op. een van deze atomen door het elektron van het andere atoom en afstotingskrachten tussen de elektronen en de kernen van de twee atomen. Wanneer deze krachten een evenwicht bereiken, bevinden de twee elektronen zich in een gebied van de elektrosferen dat zich ergens tussen de twee bevindt. atomen van het molecuul, waarin beide interageren met de twee elektronen, stabiel worden, dat wil zeggen, de twee atomen delen een paar elektronen.
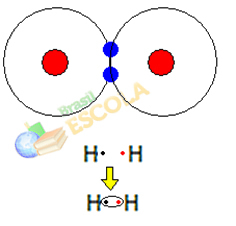
Dit is een covalente binding, die een molecuul vormt. Maar aangezien de twee atomen van dit molecuul precies hetzelfde zijn, is de manier waarop ze elektronen naar elkaar toe trekken ook hetzelfde. Dus we zeggen dat
er is geen verschil in elektronegativiteit of dat zij het is apolair.2e Voorbeeld: Waterstofchloridemolecuul: HCℓ
In dit geval wordt het delen van een elektronenpaar tussen verschillende elementen uitgevoerd, omdat in dit verband het chlooratoom trekt elektronen aan met een grotere intensiteit dan waterstof. Daarom zeggen we dat chloor meer elektronegatief is dan waterstof.
Zoals weergegeven in de onderstaande afbeelding, vanwege het verschil in elektronegativiteit, a elektrische dipool (μ), dat zijn twee elektrische monopolen, waarbij elektronen de neiging hebben om meer aangetrokken te worden door chloor. Dus de binding H ─ Cℓ zal een gedeeltelijke negatieve lading hebben op chloor (δ-) en een gedeeltelijke positieve lading op waterstof (δ+). Dus dit is een molecuul met elektronegativiteitsverschil en is polair:
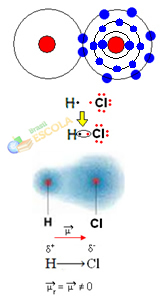
Dit laat ons zien dat elektronegativiteit een relatieve in plaats van een absolute hoeveelheid is, omdat deze wordt bepaald door vergelijkingen van krachten die worden uitgeoefend door atomen in een covalente binding in aanmerking te nemen.
Er zijn verschillende manieren om elektronegativiteit te berekenen, maar de meest voorkomende is: de door Pauling voorgestelde elektronegativiteitsschaal. Laten we zeggen dat we een generiek molecuul hebben A B. Pauling stelde voor dat de bindingsenergie van dit molecuul, gesymboliseerd door D, zou worden gegeven door de som van het rekenkundig gemiddelde van de bindingsenergieën (D) van de gasmoleculen van deze twee atomen, dat wil zeggen A-A en B-B, met het kwadraat van het verschil in elektronegativiteiten van elk atoom van dat molecuul (XDE en xB):
D(AB) = [D(A-A) + D(BB)]+k(xDE - xB)2
De constante k in bovenstaande formule is gelijk aan 96,5 kJ. mol-1. Pauling kende een willekeurige waarde toe voor de elektronegativiteit van waterstof, die 2,1 was, en, op deze manier was het mogelijk om de elektronegativiteitswaarde van de andere elementen te ontdekken in relatie tot hij.
Op basis van deze methode werden de Pauling elektronegativiteitswaarden gegeven voor de elementen van het periodiek systeem, met uitzondering van de edelgassen.

Merk op dat deze waarden een periodieke eigenschap zijn, omdat ze periodiek variëren op basis van de atoomnummers van de elementen. Zie bijvoorbeeld dat de meest elektronegatieve elementen die in de rechterbovenhoek van de tabel zijn, dat wil zeggen fluor (4,0) en zuurstof (3,5), en de minst elektronegatieve zijn die in de linkerbenedenhoek, die francium (0,8) en cesium zijn (0,8).
Op basis hiervan werd zelfs een rij elektronegativiteit gecreëerd van de meest elektronegatieve elementen die het meest worden bewerkt:
F > O > N > Cℓ > Br > I > S > C > P > H
Zie de elektronegativiteitswaarden:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Er is een soort "truc" om deze rij elektronegativiteit te versieren, die wordt gegeven door de onderstaande zin, waarin de initiaal van elk woord overeenkomt met het symbool van de elementen in kwestie:
“FHoi Oheb geen neeO klube, brik heb ikzoOuch Çstervende Pvoor de Hziekenhuis"
Dus dat kunnen we zeggen elektronegativiteit is een periodieke eigenschap die van links naar rechts en van onder naar boven op het periodiek systeem toeneemt.

Dit komt door de grootte van de atomaire straal. Hoe groter de straal van een atoom, hoe verder de gedeelde elektronen van de kern verwijderd zijn en hoe zwakker de aantrekkingskracht tussen hen. Het tegenovergestelde is ook waar, hoe kleiner de atomaire straal, hoe dichter de elektronen bij de kern zullen zijn en hoe groter de aantrekkingskracht tussen hen. We kunnen dus het volgende concluderen:
Elektronegativiteit neemt toe met afnemende atoomstraal.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/eletronegatividade.htm
