Bij een isotherme transformatie is de volume- en drukvariatie van een bepaald gas, maar de constante temperatuur; vandaar de oorsprong van de isotherme naam (Grieks: iso = gelijk; thermoskan = warmte).
Wetenschappers Boyle en Mariotte voerden afzonderlijk soortgelijke experimenten uit en het verkregen resultaat was: naarmate de druk toeneemt, neemt het volume van het gas af.
Denk maar aan bijvoorbeeld de zuiger van een spuit. Als we externe druk uitoefenen op deze zuiger, dat wil zeggen, als we de druk verhogen, zal het luchtvolume dat in de spuit wordt ingenomen afnemen, en vice versa.
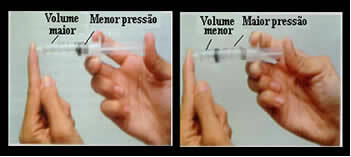
Volume en druk zijn omgekeerd evenredig: in het linkerpaneel is de druk klein en het door lucht ingenomen volume groot. Aan de rechterkant, wanneer er meer druk wordt uitgeoefend op de zuiger van de spuit, neemt het volume af.
Dit is geen alleenstaand geval, het is iets dat met algemene regelmaat wordt herhaald voor gassen. Daarom werd dit feit vastgelegd in de vorm van een wet, die als volgt kan worden beschreven:
| De wet van Boyle of Wet van Boyle-Mariotte: Bij constante temperatuur is het volume dat wordt ingenomen door een vaste massa van een gas omgekeerd evenredig met zijn druk. |
Dit betekent dat als we de druk van een gas verdubbelen, het volume zal halveren, enzovoort. Wanneer twee van dergelijke grootheden omgekeerd evenredig zijn, is hun product een constante; dus wiskundig gezien kan deze relatie als volgt worden weergegeven:
| PV = k |
Waar k = constant.
Dus als we in een eerste situatie de drukwaarde van een bepaald gas hebben als P1 en het respectieve volume als V1, dan moeten we:
| P1. V1 = k |
Als we deze druk verhogen tot P2, zal het volume ook worden gewijzigd in V2 en opnieuw moeten we:
| P2 . V2 = k |
Zo komen we tot de conclusie:
| P1. V1 =P2. V2 |
Deze constantheid is te zien aan het voorbeeld in de onderstaande tabel van de drukken en volumes van een gas met een vaste massa:
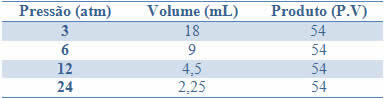
Door deze waarden in een grafiek uit te tekenen, zullen we de vorming van een curve zien.
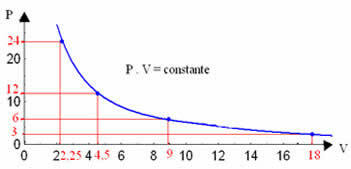
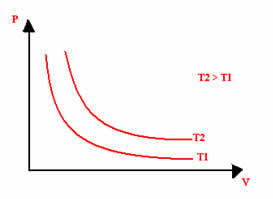
De grafische weergave van een isotherme transformatie zal altijd een hyperbool zijn, ongeacht de waarden van druk en volume en temperatuur waarbij het experiment werd uitgevoerd. Deze hyperbool heet isotherm; dus, zoals te zien is in de onderstaande grafiek, leiden verschillende temperaturen tot verschillende isothermen.
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm
