Baseren is anorganische stof die volgens de Zweedse chemicus Svante Arrhenius, wanneer geplaatst in water, lijdt het fenomeen van ionische dissociatie, waarin sprake is van de release van ionen: kation (Y+) en hydroxide-anion (OH-).

Algemene formule van een Arrhenius-base
de Y-groep van a baseren het kan elk metaal zijn of anders van de ammoniumgroep (NH4+), die tijdens dissociatie als kationen in water vrijkomen, zoals te zien is in de vergelijking die het proces weergeeft:
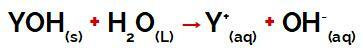
Vergelijking die de dissociatie van een base weergeeft
Zie hieronder enkele zeer belangrijke informatie met betrekking tot de classificatie en nomenclatuur van basissen.
1) Classificatie met betrekking tot de oplosbaarheid van basen(mogelijkheid om oplossen in het water)
basissen oplosbaar: alkalimetaal of ammonium in de samenstelling hebben;
basissen slecht oplosbaar: hebben aardalkalimetaal qua samenstelling. Voorbeeld: magnesiumhydroxide, veel gebruikt als antacidum en laxeermiddel;
basissen praktisch onoplosbaar: een ander metaal in de samenstelling hebben. Voorbeeld: aluminiumhydroxide, veel gebruikt als antacidum.
2) Classificatie met betrekking tot de kracht van de basis(mogelijkheid om dissociëren in het water)
basissen sterk: alkali- of aardalkalimetalen, met uitzondering van magnesium, in de samenstelling hebben;
basissen zwak: een ander metaal in de samenstelling hebben.
3) Basis nomenclatuur
Volg de onderstaande naamgevingsregel om een basis een naam te geven:
Hydroxide + de + naam van metaal of ammonium
Voorbeeld: Ca(OH)2 → calciumhydroxide
Als de base een chemisch element heeft dat niet tot de IA-, IIA- of IIIA-families behoort (en dat is niet de zilver of zink), moeten we voor de naam van het element, in Romeinse cijfers, het aantal aangeven hydroxylen:
Voorbeeld: Ti (OH)4 → titaanhydroxide IV
Door mij Diogo Lopes
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm
