A tweede wet van de thermodynamica bepaalt welke voorwaarden er zijn voor de warmte worden omgezet in werk in warmtemotoren en koelkasten. Ook wordt ingegaan op de definitie van entropie als een fenomeen dat in staat is de desorganisatie van deeltjes in fysieke systemen te meten.
Lees ook: Calorimetrie - de tak van de natuurkunde die warmte-uitwisseling bestudeert
Samenvatting over de tweede wet van de thermodynamica
De tweede wet van de thermodynamica wordt vertegenwoordigd door de uitspraken van Clausius en Kelvin-Planck.
De verklaring van Clausius gaat over de warmtestroom van het hetere lichaam naar het koudere lichaam.
De verklaring van Kelvin-Planck gaat in op het onvermogen van thermische apparaten om al hun warmte om te zetten in werk.
De tweede wet van de thermodynamica wordt toegepast op warmtemotoren en koelkasten.
De Carnot-cyclus is de maximale efficiëntiecyclus die wordt verkregen door warmtemotoren.
De Carnot-cyclus heeft vier fasen, een reversibele isotherme expansie, een reversibele adiabatische expansie, een reversibele isotherme compressie en een reversibele adiabatische compressie.
De stelling van Carnot verwijst naar de opbrengst van Carnot-machines.
Wat is de tweede wet van de thermodynamica?
De tweede wet van de thermodynamica is a wet die de beperkingen aanpakt die optreden bij thermodynamische processen. Het werd verkondigd door de natuurkundigen Rudolf Clausius (1822-1888), Lord Kelvin (1824-1907) en Max Planck (1858-1947), zoals we hieronder zullen zien:
De natuurkundige en wiskundige Rudolf Clausius stelde dat de geleiding van warmte plaatsvindt van het lichaam met hogere temperatuur naar het lichaam met lagere temperatuur. lagere temperatuur, daarom is het niet natuurlijk dat het omgekeerde proces plaatsvindt, daarom is het noodzakelijk hieraan te werken systeem. Daarmee verklaarde hij:
Het is onmogelijk om een proces uit te voeren waarvan het enige effect is dat warmte wordt overgedragen van een kouder lichaam naar een heter lichaam.|1|
De wiskundig natuurkundige William Thomson, bekend als Lord Kelvin, samen met de bijdragen van de natuurkundige Max Planck, verklaarde de onmogelijkheid van thermische apparaten met een efficiëntie van 100%, aangezien er altijd warmteverlies zal zijn.
Toepassingen van de tweede wet van de thermodynamica
De tweede wet van de thermodynamica wordt toegepast op warmtemotoren en koelkasten.
Tweede wet van de thermodynamica in machines thermisch
Naar de Thermische machines zijn in staat warmte om te zetten in arbeid. Een hete bron levert warmte aan de warmtemotor, die deze omzet in arbeid. De rest van de warmte stuurt het naar de koudebron, zoals weergegeven in de onderstaande afbeelding:
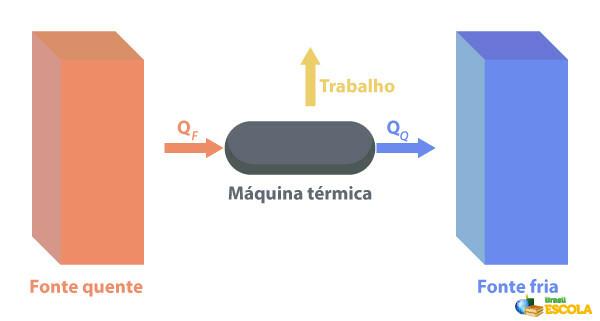
Enkele voorbeelden van thermische machines zijn: stoom- en kerosineturbines in straalvliegtuigen, verbrandingsmotoren, thermonucleaire reactoren.
Tweede wet van de thermodynamica in koelkasten
Koelkasten zijn machines die Ze werken op de tegenovergestelde manier van warmtemotoren., waar ze warmte uit een regio halen met temperatuur lagere temperatuur en voer het naar een regio met een hogere temperatuur. Aangezien dit niet natuurlijk is, is het noodzakelijk dat de machine werkzaamheden verricht met behulp van elektrische energie, zoals beschreven in onderstaande afbeelding:
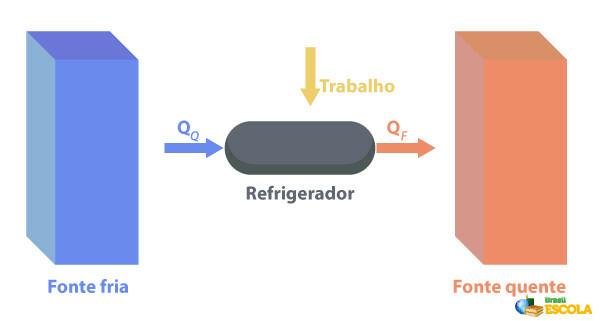
Enkele voorbeelden van koelkasten zijn koelkasten en airconditioners.
Entropie en de tweede wet van de thermodynamica
A tweede wet van de thermodynamica stelt het bestaan van entropie voor, een fysieke hoeveelheid verantwoordelijk voor het meten van de mate van desorganisatie van deeltjes in een fysiek systeem of de mate van onomkeerbaarheid van thermodynamische processen die betrokken zijn bij warmtemotoren, zijn spontaan, onvermijdelijk, onomkeerbaar en expansief. Hiermee is het alleen mogelijk om de mate van volatiliteit van de processen te observeren en te beheersen. Naarmate de entropie toeneemt, neemt ook de mate van wanorde in het systeem toe.
A Entropie-nomenclatuur is van Griekse oorsprong en betekent "transformatie"., "veranderen", dus gebruikt in de Fysiek om willekeur en wanorde aan te duiden. Entropie kan worden berekend met de formule:
\(∆S=\frac{∆U}T\)
\(∆S\) is de entropieverandering, gemeten in [J/K].
\(∆U\) is de verandering in interne energie, gemeten in Joules [J].
T is de temperatuur, gemeten in Kelvin [K].
Vanuit statistisch oogpunt wordt entropie berekend met de formule:
\(S=k\cdot ln\ Ω\)
S is de entropie, gemeten in [J/K].
k is de constante van Boltzmann, het is de moeite waard \(1,4\cdot 10^{-23}\ J/K\).
Ω is het aantal mogelijke microtoestanden voor het systeem.
Lees ook: Warmtevoortplantingsprocessen
Formules van de tweede wet van de thermodynamica
Thermische machines en koelkasten
\(Q_Q=W+Q_F\)
\(Q_Q\) is de warmte van de hete bron, gemeten in Joules [J].
W is het werk van de warmtemotor, gemeten in Joules [J].
\(Q_F\) is de warmte van de koudebron, gemeten in Joule [J].
Het kan worden weergegeven door:
\(W=Q_Q-Q_F\)
W is het werk van de warmtemotor, gemeten in Joules [J].
\(Q_Q\) is de warmte van de hete bron, gemeten in Joules [J].
\(Q_F\) is de warmte van de koudebron, gemeten in Joule [J].
Koelkasten
\(η=\frac{Q_F}{Q_Q-Q_F}\)
\(η\) is de efficiëntie van de koelkast.
\(Q_F\) is de warmte van de koudebron, gemeten in Joule [J].
\(Q_Q\) is de warmte van de hete bron, gemeten in Joules [J].
Het kan worden weergegeven als:
\(η=\frac{Q_F}W\)
\(η\) is de efficiëntie van de koelkast.
\(Q_F\) is de warmte van de koudebron, gemeten in Joule [J].
W is het werk van de warmtemotor, gemeten in Joules [J].
Voorbeelden toepassing van formules
Voorbeeld 1: Bereken het werk dat een warmtemotor verricht tijdens een cyclus die 500 J warmte ontvangt van de hete bron en slechts 400 J warmte overdraagt aan de koude bron.
Om het werk van een warmtemotor te berekenen, gebruiken we de formule:
\(W=Q_Q-Q_F\)
Vervanging van de waarden die in de verklaring worden aangegeven:
\(W=500-400\)
\(B=100\ J\)
Het werk van de warmtemotor was 100 Joules.
Voorbeeld 2: Wat is het rendement van een koelkast die 150 J warmte ontvangt van de hete bron en 50 J warmte afgeeft aan de koude bron?
Om de efficiëntie van een koelkast te berekenen, gebruiken we de formule:
\(η=\frac{Q_F}{Q_Q-Q_F}\)
Als we de waarden in de verklaring vervangen, krijgen we:
\(η=\frac{50}{150-50}\)
\(η=\frac{50}{100}\)
\(η=0,5\)
Vermenigvuldiging van de opbrengst met 100%:
\(η=0.5\cdot100%\)
\(η=50\%\)
De koelkast heeft een rendement van 50%.
Carnot-cyclus
De Carnot-cyclus was ontwikkeld door wetenschapper Sadi Carnot (1796-1832), met als doel het maximale rendement te identificeren dat kan worden bereikt door een thermische motor die werkt tussen een hete bron en een koude bron.
Op basis van zijn studies stelde Carnot vast dat, om het maximale rendement uit een warmtemotor te halen, dat wel het geval is nodig om zijn proces omkeerbaar te maken, dus ontwikkelde hij de maximale opbrengstcyclus genaamd de cyclus van Carnot, en de De warmtemotor die er doorheen werkt, wordt een Carnot-warmtemotor genoemd.. Omdat de Carnot-cyclus omkeerbaar is, kan deze worden omgekeerd, en zo zijn koelkasten ontwikkeld.
De Carnot-cyclus, ongeacht de gebruikte stof, bestaat uit vier processen die worden beschreven in de grafiek van druk per volume (p×V), zoals we kunnen zien in de onderstaande afbeelding:
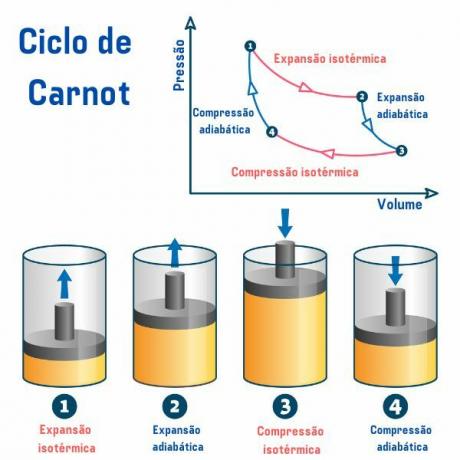
1e proces, vanaf punt 1 → 2: er is een omkeerbare isotherme uitzetting (proces waarbij de temperatuur constant blijft), waarbij het gas (of systeem) wel werkt en een hoeveelheid warmte krijgt van de hete bron.
2e proces, vanaf punt 2 → 3: er is een adiabatische uitzetting (proces waarbij er warmte-uitwisseling is met de externe omgeving) omkeerbaar, waarbij er geen warmte-uitwisseling is warmte met thermische bronnen, maar het gas werkt wel en er is een afname van de interne energie, waardoor de temperatuur.
3e proces, vanaf punt 3 → 4: er treedt een omkeerbare isotherme compressie op, waarbij het gas arbeid ontvangt en een hoeveelheid warmte afstaat aan de koudebron.
4e proces, vanaf punt 4 → 1: er treedt een reversibele adibatische compressie op, waarbij geen warmte-uitwisseling met de thermische bronnen plaatsvindt en het gas wel verwarmd totdat het de temperatuur van de hete bron bereikt en daarmee in contact wordt gebracht, waardoor de fiets.
wetten van de thermodynamica
De wetten van de thermodynamica zijn vier wetten die de hele studie van regelen thermodynamica, bestudeer de relaties tussen volume, temperatuur en druk en andere fysieke grootheden, zoals warmte en energie.
Nulde wet van de thermodynamica: is de wet van thermische balansbestudeert het de uitwisseling van warmte tussen lichamen met verschillende temperaturen.
eerste wet van de thermodynamica: is de wet van behoud van energie in thermodynamische systemen, het bestudeert de transformatie van warmte in arbeid en/of interne energie.
Tweede wet van de thermodynamica: het is de wet die zich bezighoudt met warmtemotoren, koelkasten en entropie.
Derde wet van de thermodynamica: is de wet van absolute nulpunt, bestudeert ze de effecten van deze temperatuur.
Lees ook: Prestaties van warmtemotoren
Opgeloste oefeningen over de tweede wet van de thermodynamica
vraag 1 Bepaal de temperatuur van de hete bron van een Carnot-motor, wetende dat de temperatuur van de koude bron 450 K is en dat het rendement 80% is.
a) 2250K
b) 450K
c) 1500K
d) 900K
e) 3640 K
Oplossing:
Alternatief A. We zullen de temperatuur van de hete bron berekenen op basis van de efficiëntieformule van een Carnot-motor:
\(η=1-\frac{T_F}{T_Q} \)
\(80 \%=1-\frac{450}{T_Q} \)
\(\frac{80}{100}=1-\frac{450}{T_Q} \)
\(0,8=1-\frac{450}{T_Q} \)
\(0,8-1=-\frac{450}{T_Q} \)
\(-0,2=-\frac{450}{T_Q} \)
\(0,2=\frac{450}{T_Q} \)
\(T_Q=\frac{450}{0,2}\)
\(T_Q=2250\ K\)
vraag 2 (Cefet-PR) Het 2e principe van de thermodynamica kan als volgt worden verwoord: “Het is onmogelijk om een machine te bouwen thermische energie die in cycli werkt, waarvan het enige effect is om warmte uit een bron te verwijderen en integraal om te zetten in werk". Bij uitbreiding leidt dit principe tot de conclusie dat:
a) Het is altijd mogelijk om thermische machines te bouwen met een rendement van 100%.
b) elke warmtemotor heeft slechts één warmtebron nodig.
c) warmte en arbeid zijn geen homogene grootheden.
d) elke warmtemotor haalt warmte uit een hete bron en geeft een deel van die warmte af aan een koude bron.
e) alleen met een koudebron, altijd op 0 °C gehouden, zou het voor een bepaalde warmtemotor mogelijk zijn om warmte volledig om te zetten in arbeid.
Oplossing:
Alternatief D. Dit principe vertelt ons dat het onmogelijk is om alle warmte van de hete bron te verwijderen en over te dragen aan de koude bron.
Opmerking
|1| Basiscursus natuurkunde: vloeistoffen, oscillaties en golven, warmte (vol. 2).
Door Pamella Raphaella Melo
Natuurkunde leraar
Bron: Braziliaanse school - https://brasilescola.uol.com.br/fisica/segunda-lei-da-termodinamica.htm
