een additie reactie is een chemisch proces waarbij atomen van een anorganische stof worden toegevoegd aan een organisch molecuul, dat een van de volgende kenmerken moet hebben:
Open structuur met binding of pi-links;
Verzadigde gesloten structuur (alleen bij sigma-links);
Gesloten onverzadigde structuur (met een pi of aromatische binding).
De organische verbindingen met deze kenmerken zijn als volgt: Koolwaterstoffen:
alkenen;
Alkynen;
Alkadiënen;
Cyclanen;
cycli;
Aromaten.
Tijdens een additie reactie, een of meer pi-bindingen of een sigma-binding (in het exclusieve geval van een cyclaan) zijn verbroken waardoor er twee of meer vrije valenties verschijnen (bindingsplaatsen) op de betrokken koolstofatomen, zoals in het voorbeeld balg:
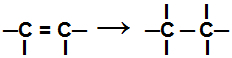
De pi-binding in een alkeen verbreken
Nadat deze binding is verbroken, moet de toevoeging van atomen plaatsvinden op de nieuwe bindingsplaatsen die in de organische verbinding zijn gecreëerd. We vermelden hieronder de soorten: toevoeging reacties dat kan met organische verbindingen.
hydrogenering
In deze additie reactie, naast de organische verbinding, is de andere reactant waterstofgas (H2). In elk van de koolstofatomen, waar de splijting plaatsvindt (verbreking van de sigma- of pi-binding, zoals eerder gezien), zal er de binding zijn van een waterstofatoom dat verwijst naar de hoeveelheid verbroken bindingen.
Wanneer we bijvoorbeeld de hydrogenering van cyclobutaan uitvoeren, wordt een sigma-binding verbroken tussen koolstof 1 en 2. Vervolgens bindt een waterstofatoom aan elk van deze koolstoffen:
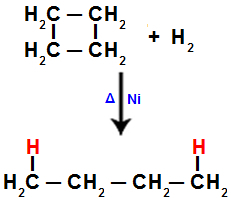
Vergelijking die hydrogenering in cyclobutaan weergeeft
Halogenatie
Naast de organische verbinding, het andere reagens in deze additie reactie is een moleculair halogeen (chloor-Cl gas2, fluor-F-gas2, vast jodium-I2 en vloeibaar broom-Br2). Bij elke koolstof, waar de splijting plaatsvindt (verbreken van de sigma- of pi-binding, zoals hierboven te zien), zal er de binding zijn van een atoom van halogeen verwijzend naar het aantal verbroken verbindingen.
Dus, wanneer we de halogenering (met behulp van chloorgas) van cyclopropeen uitvoeren, wordt de pi-binding verbroken tussen koolstof 1 en 2. Vervolgens bindt een chlooratoom aan elk van deze koolstoffen:

Vergelijking die halogenering in cyclopropeen weergeeft
Toevoegingsreactie met halogenide
Een halogenide is een anorganisch hydrazuur, gevormd door een waterstofatoom en een waterstofatoom. halogeen, zoals zoutzuur (HCl), fluorwaterstofzuur (HF), waterstofbromide (HBr), zuur hydrojood (HI).
Bij additie reactie met halogenide, naast de organische verbinding, is het andere reagens een halogenide, vandaar één van de koolstoffen, waar de splitsing (verbreken van de sigma- of pi-binding, zoals hierboven te zien), moet het waterstofatoom ontvangen en de andere ontvangt de halogenide.
Volgens de Regel van Markovnikov, moet het meest gehydrogeneerde koolstofatoom (of de koolstof die aan een kleinere radicaal is bevestigd) de ontvangen waterstof, en de minder gehydrogeneerde koolstof (of de koolstof gehecht aan een grotere radicaal) moet de must halogenide.
Wanneer we deze reactie bijvoorbeeld uitvoeren op propeen met zoutzuur (HCl), wordt de pi-binding verbroken tussen koolstof 1 en 2. Vervolgens bindt waterstof aan koolstof 1 (meer gehydrogeneerd) en chloor aan koolstof 2 (minder gehydrogeneerd):
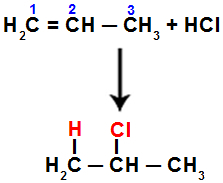
Vergelijking die de toevoeging vertegenwoordigt met halogenide in propeen
Hydratatie reactie
Het watermolecuul produceert bij ionisatie het hydroniumkation (H+) en het hydroxide-anion (OH-). Om die reden, in deze additie reactie, naast de organische verbinding, is de andere reactant water. Dus een van de koolstofatomen, waar de splijting plaatsvindt (verbreken van de sigma- of pi-binding, zoals hierboven te zien), ontvangt het hydroniumkation en de andere ontvangt het hydroxide-anion.
Volgens de regel van Markovnikov is het meest gehydrogeneerde koolstofatoom (of de koolstof die aan een kleinere radicaal is bevestigd) moet het hydronium ontvangen, en de minder gehydrogeneerde koolstof (of de koolstof die aan een grotere radicaal is bevestigd) moet de. ontvangen hydroxide.
Wanneer we bijvoorbeeld penta-1,4-dieen hydrateren, wordt de pi-binding verbroken tussen koolstoffen 1 en 2, en tussen koolstoffen 4 en 5. Vervolgens krijgen koolstofatomen 1 en 5 het hydronium en koolstofatomen 2 en 4 het hydroxide:
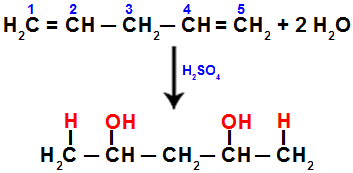
Vergelijking die optelling met hydratatie in penta-1,4 dieen voorstelt
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-reacao-adicao.htm