In het dagelijks leven en in laboratoria zijn er reacties en transformaties die spontaan zijn en andere die niet spontaan zijn. Alle verbranding is bijvoorbeeld een spontane reactie, omdat deze, eenmaal gestart, doorgaat totdat alle brandstof is verbruikt of totdat alle zuurstof op is.
Aan de andere kant is elektrolyse een niet-spontaan proces, waarbij elektrische energie wordt omgezet in chemische energie. Een voorbeeld is de elektrolyse van natriumchloride (NaCl). Wanneer een elektrische stroom over dit gesmolten zout wordt geleid, ontstaan er redoxreacties en de vorming van metallisch natrium (Na(en)) en chloorgas (Cl2(g)). Als we stoppen met het laten lopen van elektrische stroom, gaat de reactie niet vanzelf verder, wat aantoont dat het niet spontaan is.
De spontaniteit van een reactie kan worden gemeten met behulp van de Gibbs-Helmholtz-vergelijking, onder aangegeven:

Op wat:
∆G = variatie van vrije energie;
∆H = enthalpieverandering;
T = temperatuur in Kelvin (altijd positief);
∆S = entropieverandering.
Deze vergelijking dankt zijn naam aan het voorstel van de Amerikaanse natuurkundige J. Willard Gibbs (1839-1903) en door de Duitse natuurkundige Hermann Helmholtz (1821-1894).
Om beter te begrijpen hoe deze vergelijking ons helpt de spontaniteit van een reactie te bepalen, laten we kort elk van de betrokken concepten bekijken:
- ∆H (enthalpievariatie): Enthalpie (H) is de energie-inhoud van een stof. Tot nu toe is er geen manier om het te bepalen bekend. In de praktijk wordt bereikt door de enthalpievariatie (∆H) van een proces te meten met behulp van calorimeters. Deze variatie is het bedrag van energie die vrijkomt of wordt geabsorbeerd in het proces.
- ∆S (entropievariatie):Entropie (S) is de thermodynamische grootheid die de mate van wanorde in een systeem meet.
In smeltend ijs bewegen moleculen bijvoorbeeld van een vaste naar een vloeibare toestand, waar er meer desorganisatie is. Dit betekent dat in dit proces de entropie toenam (∆S > 0).
Bij de productie van ammoniak (NH3), reageert 1 mol stikstofgas met 3 mol waterstofgas (dwz 4 mol moleculen in de reactanten), waardoor 2 mol ammoniak ontstaat:
nee2(g) +3 H2(g) → 2 NH3(g)
Omdat het aantal moleculen in de gasfase in dit proces afneemt, nam de desorganisatie af, wat betekent dat de entropie ook afnam (∆S< 0).
- ∆G (vrije energie): Gratis energie of Gibbs gratis energie (omdat het alleen door deze wetenschapper in 1878 werd voorgesteld) is de nuttige energie van het systeem dat wordt gebruikt om werk te doen.
Een systeem heeft wereldwijde energie, maar slechts een fractie van die energie zal worden gebruikt om werk te doen, dit wordt Gibbs vrije energie genoemd, gesymboliseerd door G.
Volgens Gibbs, een proces wordt als spontaan beschouwd als het arbeid verricht, dat wil zeggen als G afneemt. In dit geval zal de eindtoestand van de transformatie stabieler zijn dan de initiële wanneer ∆G < 0.
Op basis hiervan kunnen we het volgende concluderen:

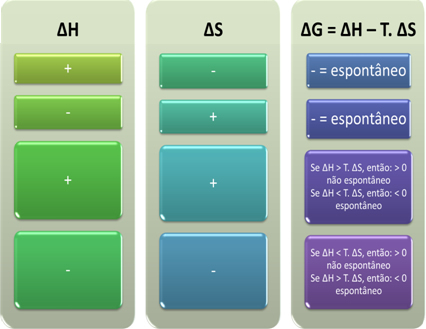
We kunnen ook zien of een proces spontaan zal zijn door te kijken naar het algebraïsche teken van ∆H en ∆S in de Gibbs-Helmholtz-vergelijking:
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm

