De bufferoplossing is meestal een mengsel van een zwak zuur en het zout van dat zuur, of een zwakke base en het zout van die base. Deze oplossing is bedoeld om zeer grote variaties in pH of pOH van een oplossing te voorkomen.
Hieronder staan enkele voorbeelden van bufferoplossingen:
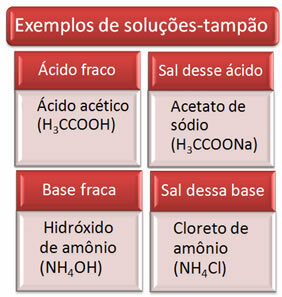
De effectiviteit van de bufferoplossing is te zien in ons bloed, waar, zelfs met de toevoeging van zuur of base in kleine hoeveelheden aan bloedplasma, er praktisch geen verandering in de pH is.
Hoe komt dit, aangezien als we zuren of basen aan water toevoegen, de pH snel verandert?
Menselijk bloed is een enigszins basisch buffersysteem, dat wil zeggen, het is een gebufferde vloeistof: de pH blijft constant tussen 7,35 en 7,45. Een van de meest interessante en belangrijke buffers in het bloed wordt gevormd door koolzuur (H2CO3) en door het zout van dit zuur, natriumbicarbonaat (NaHCO3).
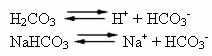
Er zijn dus de volgende soorten in deze bufferoplossing:
H2CO3: aanwezig in grote hoeveelheden, aangezien het een zwak zuur is, lijdt het weinig ionisatie;
H+: van de ionisatie van H2CO3;
HCO3-: ook in grote hoeveelheden aanwezig door de ionisatie van H2CO3 en zoutdissociatie (NaHCO3);
Bij+: van de ionisatie van NaHCO3;
Als een kleine concentratie zuur aan deze oplossing wordt toegevoegd, zal de ionisatie plaatsvinden, waardoor H-kationen worden gegenereerd+, die zal reageren met HCO-anionen3- aanwezig in het medium, afkomstig van niet-geïoniseerd koolzuur. Er is geen verandering in de pH.
Als een base wordt toegevoegd, worden OH-anionen gegenereerd-. Deze ionen combineren met de H-kationen+, van de ionisatie van H2CO3. Dus de OH-anionen- worden geneutraliseerd, waardoor de pH van het medium behouden blijft.
Naast deze genoemde bufferoplossing zijn er nog twee andere in het bloed aanwezig, namelijk: H2STOF4/HPO42- en sommige eiwitten. Als er geen dergelijke bufferoplossingen in het bloed zouden zijn, zou het pH-bereik ernstig vertekend kunnen zijn. Als de pH van het bloed boven de 7,8 komt, wordt dit alkalose genoemd. Als de pH te veel daalt, onder de 6,8, is er sprake van een staat van acidose. Beide zijn gevaarlijke omstandigheden die tot de dood kunnen leiden.

Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/solucaotampao-no-sangue-humano.htm

