De brandstoffen die in de meeste auto's worden gebruikt, zijn benzine en ethanol. Bij volledige verbranding van deze twee brandstoffen komt kooldioxide (CO2(g)) en water (H2O). Helaas kunnen bij onvolledige verbranding en de onzuiverheden in alcohol en benzine stoffen ontstaan die zeer vervuilend zijn voor het milieu. In het geval van benzine, koolmonoxide (CO(g)); koolwaterstoffen (verbindingen bestaande uit koolstof en waterstof), zoals ethaan (C2H6(g)); en stikstofoxiden (NOX), voornamelijk stikstofmonoxide (NO) en stikstofdioxide (NO2(g)).
Dus, om een toename van luchtvervuiling te voorkomen, hebben alle auto's apparatuur nodig genaamd katalysator of katalysator, een apparaat om vervuiling tegen te gaan, dat de functie heeft om deze gassen die vrijkomen door de verbrandingsmotor te behandelen en om te zetten in minder schadelijke gassen. In sommige industriële processen worden hiervoor ook katalysatoren gebruikt.
De genoemde vervuilende gassen verlaten de motor en komen de katalysator binnen, via een soort "korf", waarvan de cellen over het algemeen zijn gemaakt van keramisch of metallisch materiaal, dat is gecoat met aluminiumoxide (aluminiumoxide - Al
2O3). Deze honingraatvorm, met minuscule kanaaltjes, is belangrijk omdat het een groot contactoppervlak biedt voor de gassen, waardoor ze sneller reageren.Maar de echte katalysator is een metaal dat bovenop aluminiumoxide zit. Typisch zijn de gebruikte metalen palladium, rhodium, platina of molybdeen. Je kunt deze metalen ook mengen en legeringen gebruiken. In het geval van benzine wordt bijvoorbeeld normaal gesproken een legering van palladium en thorium gebruikt; in het geval van ethanol wordt een andere legering van palladium en molybdeen gebruikt. Deze metalen voeren een heterogene katalyse uit met vervuilende gassen.
heterogene katalyse het is een soort reactie waarbij de katalysator met de reactanten (in dit geval de vervuilende gassen) een meerfasensysteem vormt. Dit komt omdat de katalysator adsorbeert, dat wil zeggen dat hij de moleculen van de reactanten op het oppervlak vasthoudt, hun bindingen verzwakt en het reactieproces sneller maakt.
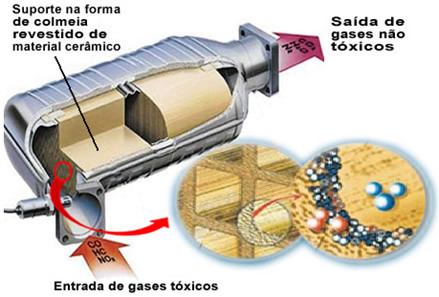
Als gevolg hiervan transformeren katalysatormetalen vervuilende stoffen zoals CO en NOX in niet-toxische gassen zoals CO2, H2O, O2 en nee2. Zie enkele van deze reacties hieronder en merk op dat er door hen oxidatie van koolwaterstoffen en CO (afkomstig van onvolledige verbranding) en ook de reductie van stikstofoxiden tot stikstofgas (N2):
2 CO(g) + 2 NEE(g) → 2 CO2(g) + 1 Nee2(g)
2 CO(g) + 1 O2(g) → 2 CO2(g)
2C2H6(g) + 7 O2(g) →4 CO2(g) + 6 H2O(v)
2 NEE2(g) +4 CO(g) →1 Nee2(g) + 4 CO2(g)
2 NEE2(g) →1 Nee2(g) + 2 O2(g)
2 NEE(g) →1 Nee2(g) + 1 O2(g)
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/conversor-catalitico.htm

