het scheikundig element fosfor (P) behoort tot de derde periode van het periodiek systeem en tot de stikstoffamilie (VA). Om deze reden maken zijn atomen normaal gesproken drie chemische bindingen om de te bereiken octet theorie (stabiliteit). Er zijn echter enkele situaties waarin een fosforatoom meer dan drie bindingen maakt, een feit dat alleen mogelijk is via de hybridisatie fenomeen.
Om de te begrijpen fosforhybridisatie, we moeten eerst begrijpen waarom het atoom van dit element drie bindingen maakt. Om dit te doen, hoeven we alleen maar uw elektronische distributie te controleren:

Elektronische fosfordistributie
We kunnen zien dat in de valentielaag het fosforatoom het volledige 3s-subniveau heeft (met ( twee elektronen) en het onvolledige 3p-subniveau (elk van de drie p-subniveau-orbitalen heeft a elektron). Hieronder hebben we de verdeling van de elektronen in de orbitalen van de subniveaus van de Fosforvalentielaag:
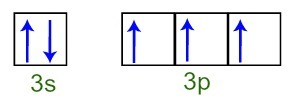
Vertegenwoordiging van de valentie-schilelektronen van het fosforatoom
Omdat elk van de 3p subniveau-orbitalen onvolledig is, kan het fosforatoom drie chemische bindingen maken, waardoor stabiliteit wordt bereikt.
Als we nu kijken naar de stof PCl5we zijn er bijvoorbeeld zeker van dat in dit molecuul de fosfor hybridisatie heeft ondergaan, omdat het vijf verbindingen heeft gemaakt. Omdat chloor, dat tot de VIIA-familie behoort, een binding nodig heeft om stabiel te zijn en het molecuul heeft vijf atomen hiervan element, moet elk van hen een binding maken, waardoor het fosforatoom op zijn beurt ook vijf. moet maken Verbindingen. Dit voorval is alleen mogelijk via de hybridisatie (vereniging van onvolledige atomaire orbitalen) van fosfor.
Bij het ontvangen van energie van de externe omgeving worden de elektronen van het fosforatoom opgewonden. Kort daarna beweegt een van de twee elektronen die behoren tot het 3s-subniveau naar een lege orbitaal in het d-subniveau, die tot dan toe geen elektronen heeft. Zie onderstaand schema:
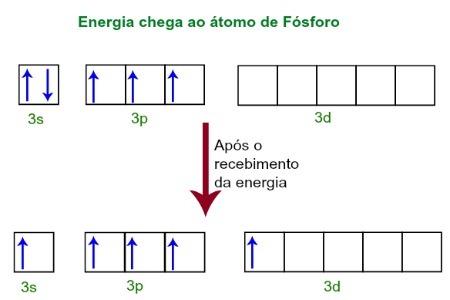
Bij het ontvangen van energie worden de elektronen van de fosfor geëxciteerd en neemt men een orbitaal van het d-subniveau in.
Op dit moment hebben we in de fosforvalentielaag een s-orbitaal, drie p-orbitalen en een onvolledige d-orbitaal.Uiteindelijk hybridiseren deze vijf orbitalen, dat wil zeggen fuseren, wat resulteert in vijf onvolledige atomaire orbitalen, die nu in staat zijn om vijf chemische bindingen te maken.

Hybridisatie van onvolledige atomaire orbitalen van fosfor
Omdat een s-orbitaal, drie p-orbitalen en een d-orbitaal werden samengevoegd, is de fosforhybridisatie van het type sp3d.
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm

