DE stereo-isomerie, ook gekend als Ruimte isomerie, is een type isomerie waarbij de isomeren worden onderscheiden doordat de bindingen tussen hun atomen anders in de ruimte zijn gerangschikt.
Er zijn twee soorten stereo-isomeren, de diastereo-isomeren en de enantiomeren. Diastereo-isomeren zijn geometrische isomeren van het cis-trans-type, die geen spiegelbeelden van elkaar zijn, terwijl enantiomeren optische isomeren zijn die spiegelbeelden van elkaar zijn.
Een beetje praten over de cis-trans diastereo-isomeer, het komt alleen voor in verbindingen die onverzadigd zijn of die cyclisch zijn. Waarom komt het niet voor in verzadigde ketenverbindingen, dat wil zeggen, die alleen enkele bindingen tussen koolstoffen hebben?
Het kan gebeuren dat we in de war raken, denkend dat bepaalde verzadigde verbindingen diastereo-isomeren zijn, terwijl ze in feite dezelfde verbinding vertegenwoordigen. Hieronder hebben we bijvoorbeeld drie ruimtelijke conformaties van de atomen van 1,2-dichloorethaan:
H H H H H kl
│ │ │ │ │ │
H — Ç — Ç — H H — Ç — Ç — ClH — Ç — Ç — H
│ │ │ │ │ │
kl klkl H kl H
Zijn dit drie diastereo-isomeren? Niet doen. Werkelijk, de drie moleculen zijn van dezelfde verbinding. Wat er gebeurt, is dat de enkele bindingen of sigma (σ) tussen koolstofatomen rotaties kunnen ondergaan, wat resulteert in verschillende atomaire rangschikkingen.
Bekijk in onderstaand schema hoe dit gebeurt met ethaan:

Deze verbindingen, die in feite dezelfde verbinding zijn, voeren geen geometrische cis-trans-isomerie uit, maar worden genoemd conformationele isomeren, omdat ze alleen verschillen in de conformatie van hun atomen veroorzaakt door rotatie rond de enkele binding.
Een van de manieren om deze moleculen weer te geven om het gemakkelijk te maken om de rotatie van de verbindingsas te visualiseren, is via de Newmans projectie, waarin het wordt beschouwd alsof het gezichtsveld precies op de as van de binding tussen de koolstoffen ligt en ze worden weergegeven door een centrale cirkel. Zie Newman's projectie voor ethaan:

We kunnen deze verschillende conformaties ook weergeven via de formule op ezels:
Deze vrije rotatie van de verbindingsas komt niet meer voor in onverzadigde verbindingen of in cyclische verbindingen. Stel je bijvoorbeeld voor dat we een eenvoudig model bouwen, dat twee koolstofatomen voorstelt door twee piepschuimballen die zijn verbonden door een tandenstoker die erin zit.
Als we een enkele tandenstoker hebben en we houden een van de ballen vast, kan de andere gemakkelijk rond zijn eigen as draaien, net als bij eenvoudig binden.

Als we echter nog een tandenstoker plaatsen die de twee bollen met elkaar verbindt, zullen we niet in staat zijn om de ene bol vast te houden en de andere te draaien. Als we dit doen, zullen de tandenstokers breken. Evenzo, wanneer er een pi-binding en een sigma (dubbele binding) is, is er een belemmering voor de rotatie van de koolstoffen.
Daarom is het in het onderstaande geval, waarin we een dubbele binding tussen de koolstofatomen hebben, geen kwestie van twee conformationele isomeren, dat wil zeggen twee conformaties voor hetzelfde molecuul; we hebben eigenlijk twee cis-trans diastereoisomeren:
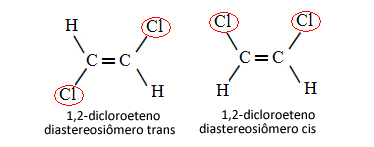
Zie meer over dit type isomerie in de tekst Geometrische of cis-trans-isomeren.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/isomeria-conformacional.htm
