Omkeerbare reacties beginnen meestal met een bepaalde hoeveelheid reagentia. Naarmate de directe reactie begint, worden deze reagentia na verloop van tijd verbruikt voor de vorming van de producten, bijgevolg neemt de concentratie van de reagentia af terwijl de concentratie van de producten neemt toe. Dan begint ook de inverse reactie, waarbij ook de reactanten worden geproduceerd, totdat de ontwikkelingssnelheid (snelheid) van de directe en inverse reacties hetzelfde blijft, de zogenaamde chemische balans.
In evenwicht is er de evenwichtsconstante Kc, die in principe wordt uitgedrukt door:
|
Kc = [producten]coëfficiënt in evenwichtige chemische vergelijking chemical [reagentia]coëfficiënt in evenwichtige chemische vergelijking chemical |
Dat wil zeggen, rekening houdend met de volgende generieke evenwichtsreactie:
a A + b B ↔ c C + d D
Aangezien de kleine letters de coëfficiënten zijn en de hoofdletters de stoffen, zal de evenwichtsconstante van deze reactie zijn:
Kc = [Ç]ç. [D]d
[DE]De. [B]B
Meer details hierover zijn te zien in de tekst Evenwichtsconstanten Kc en Kp. Deze tekst laat ons ook iets belangrijks zien: dat Kc-waarden ons kunnen laten zien of de concentratie van de reagentia en de producten gelijk zijn of als de ene groter is dan de andere en, als gevolg, als de chemische balans in de een of andere richting van de reactie.
We moeten dus de waarde van Kc bepalen. Om dit te doen, onthoud dat deze berekeningen experimenteel zijn, dus laten we eens kijken naar enkele voorbeelden van reacties en de daaruit verkregen gegevens.
Iets dat erg handig is bij het uitvoeren van deze berekeningen, is om een tabel te schrijven die lijkt op de onderstaande tabel en de daarin genoemde stappen te volgen:

Tabel om de gegevens te ordenen die worden gebruikt om de evenwichtsconstante te berekenen
Laten we nu gaan oefenen:
Voorbeeld 1: In een gesloten container, met een inhoud van 2 L, bij een temperatuur van 100°C, is er 20 mol N2O4. De volgende omkeerbare reactie begint op te treden: N2O4 NEE2. Na enige tijd bleek dat de reactie chemisch evenwicht bereikte en dat 8 mol NO2 had gevormd. Wat is de waarde van de evenwichtsconstante Kc bij een temperatuur van 100°C?
Resolutie:
Laten we de tabel gebruiken:

Tabel die wordt gebruikt om een voorbeeld van een evenwichtsconstante op te lossen:
Merk op dat in de regel waar de hoeveelheden die reageren en vormen zijn geschreven, we weten dat 4 mol N werd uitgegeven2O4, omdat de verhouding 1: 2 is, en dat 8 mol NO is gevormd2.
Vervang nu gewoon de waarden gevonden in de uitdrukking van de evenwichtsconstante Kc van deze reactie:
Kc = [BIJ DE2]2
[Nee2O4]
Kc = (4 mol/l) 2
(8 mol/L)
Kc = 2 mol/L
De waarde van Kc is dimensieloos, het heeft geen eenheid gerelateerd aan enige grootte.
Laten we nu eens kijken naar een voorbeeld, dat ook vanaf het begin producten bevat:
Voorbeeld 2: In een gesloten container, met een inhoud van 5 L, bij temperatuur T, bevinden zich 2 mol waterstofgas, 3 mol jodiumgas en 4 mol waterstofjodide. De reactie komt in chemisch evenwicht, bij temperatuur T, en het blijkt dat er 1 mol waterstofgas in het vat zit. Wat is de grafiek die dit evenwicht weergeeft en wat is de waarde van de evenwichtsconstante Kc bij de temperatuur van T?
Resolutie:
Tabel gebruiken:
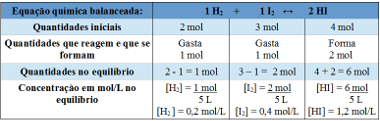
Tabel die wordt gebruikt om de evenwichtsconstante te bepalen
De grafiek die de variaties in mol/L-concentraties van reagentia en producten toont totdat ze een evenwicht bereiken, kan worden gegeven door:

Chemische evenwichtsgrafiek die veranderingen in concentraties van reagentia en producten toont
Nu vinden we de waarde van de evenwichtsconstante:
Kc =__[HI]2__
[H2 ]. [IK2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm