Ionische binding vindt plaats tussen ionen, zoals de naam al doet vermoeden. Omdat ze tegengestelde ladingen hebben, trekken de kationen (element met een positieve lading) en anionen (element met een negatieve lading) elkaar elektrostatisch aan en vormen zo de binding. Een ionische vaste stof wordt echter gevormd door een agglomeraat van kationen en anionen georganiseerd met goed gedefinieerde geometrische vormen, roosters of kristalroosters genoemd.
Zout (natriumchloride) wordt bijvoorbeeld gevormd door de definitieve overdracht van een elektron van natrium naar chloor, waardoor het natriumkation (Na+) en het chloride-anion (Cl-). In de praktijk omvat deze reactie niet slechts twee atomen, maar een enorm en onbepaald aantal atomen die een kubusvormig kristalrooster vormen, zoals hieronder weergegeven:
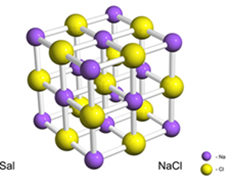
Als we zoutkristallen bekijken met een scanning-elektronenmicroscoop, zullen we zien dat ze eigenlijk kubisch zijn vanwege hun interne structuur.

Aangezien elke ionische verbinding dan bestaat uit een onbepaald en zeer groot aantal ionen, hoe kunnen we dan een ionische verbinding voorstellen?
De formule die gewoonlijk wordt gebruikt is de eenheidsformule, welke is degene die vertegenwoordigt de verhouding uitgedrukt door het kleinst mogelijke aantal kationen en anionen waaruit het kristalrooster bestaat, zodat de totale lading van de verbinding wordt geneutraliseerd. Om dit te laten gebeuren, is het noodzakelijk dat het aantal elektronen dat door een atoom wordt opgegeven, gelijk is aan het aantal elektronen dat door het andere atoom wordt ontvangen.
Enkele aspecten over de eenheidsformule van ionische verbindingen zijn belangrijk, zie enkele:
- Schrijf altijd eerst het kation en dan het anion;
- Aangezien elke ionische verbinding elektrisch neutraal is, hoeven de individuele ionenladingen niet te worden opgeschreven;
- De subscriptnummers die aan de rechterkant van elk ion verschijnen, geven de verhouding van de atomen van het kation tot het anion aan. Deze getallen worden indices genoemd en het getal 1 wordt niet geschreven.
In het geval van natriumchloride hebben we bijvoorbeeld dat de eenheidsformule NaCl is, omdat we precies 1 natriumkation hebben voor elk chloride-anion.
Zie een ander voorbeeld, Al3+ heeft drie positieve ladingen, terwijl de F- het heeft slechts één negatief, dus er zijn drie fluoride-anionen nodig om de verbinding te neutraliseren. We concluderen dus dat de eenheidsformule AlF. is3.
Een eenvoudige manier om tot de eenheidsformule van de ionische verbinding te komen, is door de ladingen uit te wisselen voor de indices, zoals hieronder op een generieke manier wordt weergegeven:
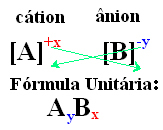
Voorbeelden:

Een andere formule die wordt gebruikt om ionische stoffen weer te geven, is de Lewis-formule of elektronische formule, wat vertegenwoordigt de elektronen van de valentieschil van de "ballen" -ionen rond het elementsymbool. In het geval van zout hebben we:

Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm



