Het vermogen dat de verbindingen hebben om elektrische ladingen aan te trekken wordt gedefinieerd als Polariteit, die een ander karakter krijgt afhankelijk van de verbinding waar deze aanwezig is.
De meest voorkomende bindingen met organische verbindingen vinden plaats tussen koolstofatomen of tussen koolstof- en waterstofatomen: C ─ C en C ─ H (koolwaterstoffen). We classificeren dit type binding als covalent, het is aanwezig in alle bindingen van organische verbindingen die alleen worden gevormd door koolstof en waterstof.
Wanneer in het molecuul van een organische verbinding naast koolstof en waterstof nog een ander chemisch element aanwezig is, zullen de moleculen een bepaalde polariteit hebben. We noemen dit element een heteroatoom en het kan onder andere zijn: stikstof (N), zuurstof (O).
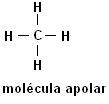
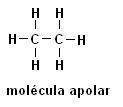
Methaan (CH4) Ethaan (C2H6)
Merk op dat er in beide structuren geen heteroatomen aanwezig zijn, in dit geval worden de moleculen geclassificeerd als niet-polair.


De aanwezigheid van zuurstof als heteroatoom zorgt ervoor dat de moleculen polariteit vertonen. Het eerste molecuul is de verbinding Ethanol (
CH3CH2Oh), geeft de aanwezigheid van hydroxyl-OH deze verbinding een polair karakter, zelfs als het in zijn structuur een niet-polair deel bevat.Door Liria Alves
Afgestudeerd in scheikunde
Brazilië School Team
Bekijk meer! platte isomeer
Organische chemie - Chemie - Brazilië School
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm

