Droogijs wordt zo genoemd omdat het, ondanks dat het eruitziet als ijs (water in vaste toestand), in feite vast koolstofdioxide is (kooldioxide - CO2). En, in tegenstelling tot gewoon ijs dat smelt, gaat het direct over in een gasvormige toestand, dat wil zeggen, het sublimeert.
Dit is de belangrijkste eigenschap van droogijs, want wanneer het verandert in een gasvormige toestand, sleept het watermoleculen mee, waardoor een mist ontstaat die dichter is dan lucht. dankzij dat "Witte rook" gevormd, het droogijs het wordt veel gebruikt als een landschappelijke bron in films, concerten, theaters, televisieprogramma's en feesten.
Maar de vraag rijst: wat is er anders aan droogijs dan andere stoffen die betrokken zijn bij de sublimatie ervan? Wat gebeurt er tussen je moleculen?
Kooldioxide is niet-polair, dus als het in vaste toestand is, zoals droogijs, is het moleculen blijven in moleculaire kristallen dankzij een intermoleculaire aantrekkingskracht ertussen, welke is de geïnduceerde dipool
. Deze kracht ontstaat wanneer je moleculen dichterbij komen en er een afstoting is tussen je elektronen, wat leidt tot tijdelijke vervormingen in je elektronische wolken. Dit betekent dat tijdelijke dipolen in de moleculen verschijnen, die aangrenzende moleculen induceren, wat resulteert in aantrekkende krachten.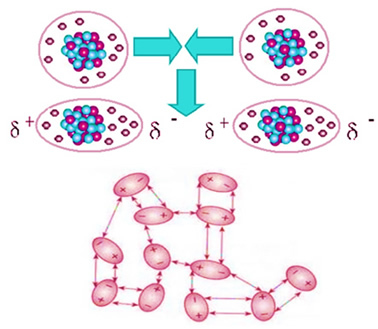
Dit is de enige intermoleculaire kracht die aanwezig is in de niet-polaire moleculen van droogijs en de intensiteit ervan is erg klein. De geïnduceerde dipoolkracht is de zwakste van allemaal. Dus, het kost weinig energie om deze krachten te breken van aantrekking en laat de verbinding zijn fysieke toestand veranderen. Daarom sublimeert droogijs bij -78,6°C, onder een druk van 1 atm.
Andere voorbeelden van stoffen die ook dit soort intermoleculaire interactie hebben en die ook sublimeren zijn: mottenballen het is de vast jodium.

Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/por-que-gelo-seco-sublima.htm
