Bij intermoleculaire krachten het zijn krachten van elektrostatische aantrekking waarvan de functie is om moleculen (moleculaire verbindingen) te verenigen en ze in vaste of vloeibare toestand te houden. Ze zijn uiterst belangrijk, omdat ze alle fysische eigenschappen bepalen (smeltpunt, kookpunt, dichtheid en oplosbaarheid) van stoffen.
In deze tekst bestuderen we de relatie tussen intermoleculaire krachten en het kookpunt van stoffen. Laten we ons eerst drie belangrijke soorten intermoleculaire krachten herinneren, namelijk:
♦ dipool dipool: is de kracht die optreedt in polaire moleculen. Omdat deze moleculen een positieve en negatieve pool hebben, is de dipool-dipoolkracht gebaseerd op de aantrekkingskracht tussen het positieve uiteinde van het ene molecuul en het negatieve uiteinde van een ander. Voorbeelden: HCl, HBr, SO2 en PH3
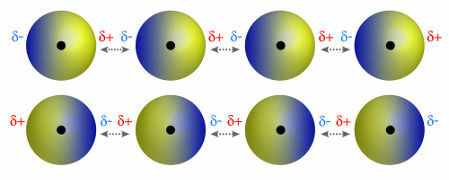
Moleculen met een positieve en negatieve pool die elkaar aantrekken
♦ geïnduceerde dipool: is de intermoleculaire kracht die alleen voorkomt in niet-polaire moleculen (ze hebben geen polen). Wanneer twee apolaire moleculen naderen, treedt er een tijdelijke vervorming van hun wolken op elektronen, wat een onbalans veroorzaakt in de elektronen van het molecuul, die in a worden verdeeld voor haar anders. Op dat moment ontstaat er een momentane dipool en heeft het molecuul even een positieve en een negatieve pool, waardoor de aantrekkingskracht ontstaat. Voorbeelden: CO
2, CH4 en BH3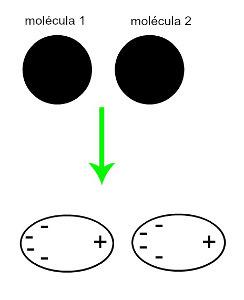
De benadering van twee niet-polaire moleculen genereert een vervorming en bijgevolg een herverdeling van elektronen, die de tijdelijke dipolen vormen
♦ Waterstofbruggen: het is de intermoleculaire kracht die optreedt in polaire moleculen, maar alleen in die waarbij waterstofatomen verplicht zijn direct gebonden aan fluor-, zuurstof- of stikstofatomen. Het kan worden beschouwd als een dipool-dipoolkracht, maar van veel grotere intensiteit. De interactie vindt altijd plaats tussen de waterstof van het ene molecuul en het andere atoom (F, O, N) van een ander molecuul. Voorbeelden: H2O, NH3 en HF
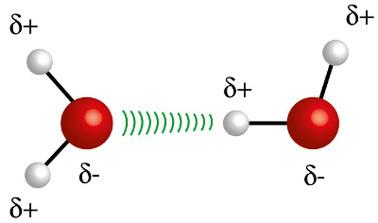
Het waterstofatoom (witte bol) van een molecuul interageert met de zuurstof (rode bol) van een ander watermolecuul
Nadat we de drie intermoleculaire krachten hebben onthouden, kunnen we ze nu relateren aan het kookpunt van stoffen. wordt genoemd kookpunt de temperatuur waarbij moleculen van een bepaalde stof niet langer in vloeibare toestand zijn (hun intermoleculaire krachten worden verbroken) en overgaan in een gasvormige toestand. Het interessante detail is dat de intermoleculaire krachten en het kookpunt van stoffen hebben een zeer intense en directe relatie, want hoe intenser de intermoleculaire kracht, hoe hoger het kookpunt. De volgorde van intensiteit van de intermoleculaire krachten is:
Geïnduceerde dipool < Dipool-dipool < Waterstofbindingen
We kunnen dus concluderen dat moleculen met waterstofbruggen als interactiekracht hogere kookpunten hebben dan die met dipool-dipool enzovoort. De onderstaande tabel toont drie stoffen en hun kookpuntwaarden:
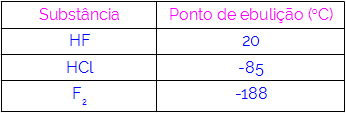
We zien in de tabel dat HF een hoger kookpunt heeft, omdat de moleculen zijn verbonden door waterstofbruggen. Stof F2 het heeft het laagste kookpunt, omdat de moleculen worden aangetrokken door een geïnduceerde dipool.
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm
