Covalente binding treedt op wanneer twee atomen elektronenparen delen om de elektronenconfiguratie van een edelgas (met 8 elektronen in de valentieschil of met 2, in het geval van die met alleen de K-schil), volgens de regel van octet.
Er zijn echter speciale gevallen van covalente bindingen waarin: het gedeelde elektronenpaar komt alleen van een van de atomen die al stabiel is. Voorheen heette dit type covalente binding datief, tegenwoordig wordt het meer in het algemeen genoemd coördineren.
Bekijk enkele voorbeelden om te begrijpen hoe dit gebeurt:
- CO (koolmonoxide):
Koolstof heeft 4 elektronen in zijn valentieschil. Daarom, volgens de octetregel, moet het, om stabiel te zijn, nog 4 elektronen ontvangen, in totaal 8. Zuurstof daarentegen heeft 6 elektronen in de valentieschil en moet 2 elektronen ontvangen om de configuratie van het edelgas-neon te krijgen.
Dus eerst delen koolstof en zuurstof twee elektronenparen, zodat zuurstof stabiel is:
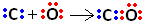
Koolstof blijft echter onstabiel omdat het nog steeds 6 elektronen heeft en er 2 nodig heeft. Daarom deelt zuurstof, dat al stabiel is, een van zijn elektronenparen met koolstof, dat wil zeggen, het maakt er een datieve binding mee, waardoor het stabiel wordt:

Merk op dat de coördinaat covalente binding kan worden weergegeven door een streepje, net als de gewone covalente binding.
- ENKEL EN ALLEEN2 (Zwaveldioxide):
Elk zwavel- en zuurstofatoom heeft 6 elektronen in hun valentieschillen, dus ze moeten elk 2 elektronen ontvangen. Aanvankelijk maakt zwavel twee gemeenschappelijke covalente bindingen, waarbij twee elektronenparen worden gedeeld met een van de zuurstofatomen, die beide stabiel blijven met 8 elektronen.
Maar het andere zuurstofatoom is niet stabiel, dus deelt zwavel een paar elektronen ermee via een gecoördineerde of datieve covalente binding:
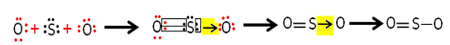
Merk op dat we in dit geval drie atomen in het molecuul hebben, dus er kan een migratie van de binding van het ene atoom naar het andere zijn. Het zwaveldioxidemolecuul kan ook als volgt worden weergegeven: O ─ S ═ O.
We noemen dit bindingsfenomeen resonantie. Zie nog drie voorbeelden in de onderstaande tabel:
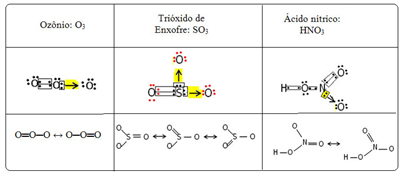
Mogelijke structuren worden genoemd resonantie structuren of canonieke vormen.
Dit type binding komt ook voor bij de vorming van ionen, zoals in het geval van hydroniumionen (H3O+) en ammonium (NH4+).
Ten eerste, het H-kation+ het vormt zich wanneer waterstof zijn enkele elektron verliest, waardoor het een positieve lading achterlaat. Het zal dus twee elektronen moeten ontvangen om stabiel te zijn. Dit gebeurt door een datiefbinding met water (in het geval van het hydroniumion) en met ammoniak (in het geval van het ammoniumion). Kijk maar:

Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm
