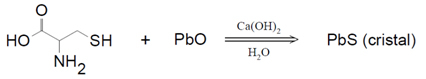Zuuroxiden zijn die oxiden die bij reactie met water een zuur als product produceren. Bij reactie met een base zullen de producten zout en water zijn.
Deze verbindingen hebben meestal een covalent karakter, dat wil zeggen, ze zijn moleculair, oplosbaar in water en worden meestal gevormd door niet-metalen, die elementen zijn met een hoge elektronegativiteit. Wanneer gevormd door metalen, hebben deze hoge oxidatiegetallen (elektrische lading).
Voorbeelden:
CO2, ENKEL EN ALLEEN2, ENKEL EN ALLEEN3, P2O5, Cl2O6, BIJ DE2, Nee2O4, Nee2O5, enz.
Het volgende is een algemeen schema van karakteristieke reacties voor zuuroxiden en een voorbeeld:

Zuuroxiden die reageren met water en met base

Zuuroxiden worden ook wel anhydriden, omdat dit woord uit het Grieks komt anhydros, wat betekent "geen water", en zuuroxiden kunnen worden beschouwd als een "waterloos zuur".
Eigenschappen en toepassingen van sommige zuuroxiden:
• Kooldioxide (kooldioxide) - CO2:
Deze verbinding wordt als gas gebruikt in frisdranken en in mineraalwater, omdat het onder hoge druk oplosbaar wordt in water. Het produceert een zuur medium in deze producten, omdat het een zuur oxide is dat reageert met water en een zuur produceert, zoals in de onderstaande reactie:

Onder de 78°C bevindt het zich in vaste toestand en staat het bekend als droogijs, dat zijn naam dankt omdat het op ijs lijkt. gebruikelijk, maar het smelt niet, gaat bij kamertemperatuur naar de vloeibare toestand, maar het gaat naar de damptoestand, dat wil zeggen, het subliem. Deze functie wordt dus gebruikt als een schilderachtige hulpbron bij concerten, films, theaters, feesten, enz.

Kooldioxide is een zuuroxide
Het wordt ook in de atmosfeer aangetroffen als gevolg van menselijke ademhaling, de verbranding van fossiele brandstoffen (kolen, aardolieproducten, alcohol, enz.) en bosbranden. Zo is hij een van de verantwoordelijken voor zure regen.
• Zwaveloxiden - SO2 en dus3
Deze oxiden zijn ook aanwezig in de atmosfeer, omdat ze van natuurlijke en kunstmatige oorsprong zijn. Het natuurlijke vindt plaats door vulkaanuitbarstingen en ontbinding van planten en dieren. Het kunstmatige komt overeen met de grootste hoeveelheid van deze oxiden in de atmosfeer, zoals ze zijn uitgestoten door verbranding van fossiele brandstoffen, voornamelijk dieselolie, die zwavel bevat zoals: onzuiverheid.
Zwaveldioxide (SO2) reageert met zuurstof uit de atmosfeer en produceert zwaveltrioxide (SO3). Wanneer dit laatste oxide reageert met regenwater ontstaat er zwavelzuur, dat zeer sterk is en schade aanricht.
• Brandende zwavel uit brandstoffen: S + O2 → besturingssysteem2
• Transformatie van SO2 naar SO3: SO2 + de2 → besturingssysteem3
Reacties van SO2 en SO3 met water gevende zuren: SO2 + H2O → H2ENKEL EN ALLEEN3
ENKEL EN ALLEEN3 + H2O → H2ENKEL EN ALLEEN4
• Distikstoftetroxiden (salpeterzuuranhydride) - N2O4
Deze verbinding heeft een kookpunt van 22ºC, heeft een gele kleur en is vrij vluchtig. Het wordt in de atmosfeer gevormd door de oxidatie van stikstof en kan in vloeibare vorm zijn, in de vorm van een dimeer van monostikstofdioxide of stikstofoxide (NO2). Boven die temperatuur neemt het de vorm aan van NO2:
nee2O4 NEE2
Het is een uiterst giftig gas en de inademing ervan is dodelijk. Het wordt ook gebruikt in de samenstelling van raketbrandstoffen.
Door Jennifer Fogaça
Afgestudeerd in scheikunde