DE Wet van Snelheid van Reactie relateert de snelheid van een chemische transformatie aan de concentraties van reagentia in hoeveelheid stof (mol/L), die als volgt kan worden aangegeven:

Beschouw bijvoorbeeld de volgende algemene reactie:
aA + bB → cC + dD
Laten we zeggen dat we de concentratie van reactanten A en B verhogen, wat gebeurt er met de reactiesnelheid? Welnu, aangezien de hoeveelheid reactantdeeltjes in dezelfde ruimte zal toenemen, zullen er effectievere botsingen tussen hen zijn, wat zal resulteren in een toename van de reactiesnelheid. Wat betekent dat het je snelheid zal verhogen.
Daarom is de reactiesnelheid recht evenredig met de concentratie van de reactanten. Het hangt echter ook af van de temperatuur. Daarom hebben we de volgende wiskundige vergelijking die de wet van de reactiesnelheid weergeeft:

Op wat:
v = reactiesnelheid;
k = constante die alleen afhangt van de temperatuurwaarde;
α en β = exponenten experimenteel bepaald.
Alleen wanneer de reactie elementair is, dat wil zeggen dat deze in een enkele stap plaatsvindt, zijn de exponenten precies gelijk aan de coëfficiënten van de gebalanceerde chemische vergelijking:
v = k. [DE]De. [B]B. In andere gevallen moet echter experimenteel worden bepaald tot welke sterkte de concentratie van elk reagens moet worden verhoogd.De wet van de snelheid van reacties kent vele namen, hier zijn er enkele: Wet van massale actie, snelheidsvergelijking, kinetische reactiewet en wet van Guldberg-Waage.
Overweeg een voorbeeld van hoe u deze wet kunt toepassen:
Beschouw de volgende elementaire reactie:
2 HCl (g) → H2(g) + Cl2(g)
a) Schrijf de vergelijking voor de snelheid van deze reactie;
b) Door middel van experimenten werden de snelheid van deze ontledingsreactie van waterstofchloridegas en de concentratie van dit reagens, bij een constante temperatuur van 25 °C, genoteerd in de onderstaande tabel:
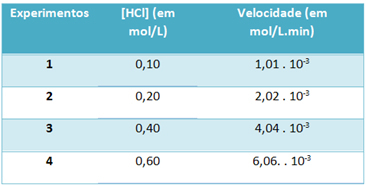
Bepaal op basis hiervan de karakteristieke snelheidsconstante van deze reactie bij de genoemde temperatuur.
Resolutie:
De) v = k. [HCl]2
b) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 mol. L-1. min-1
0,01 mol. L-1
k = 1,01. 10-1 min-1
Om de letter "b" op te lossen, kunt u de gegevens van elk van de experimenten gebruiken dat de verkregen waarde hetzelfde zal zijn.
Maar wat als de reactie niet elementair is? Hoe zal het mogelijk zijn om dit soort vragen in niet-elementaire reacties op te lossen? Lees de wet van snelheid voor niet-elementaire reacties om erachter te komen hoe.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm
