A sublimatie Het is een verandering in de fysieke toestand van de materie die wordt gekenmerkt door de directe overgang van de vaste fase naar de gasfase, zonder door de vloeibare fase te gaan. Strikt genomen kan elke substantie sublimatie ondergaan, maar onder specifieke omstandigheden van druk en temperatuur. Sublimatie is gecorreleerd met de dampdruk in de vaste fase, evenals met de intermoleculaire interacties uitgeoefend door de vaste stoffen.
Dit proces kan gemakkelijk worden waargenomen in een stuk droogijs, dat bestaat uit vast koolstofdioxide. Kooldioxide sublimeert onder druk en bij kamertemperatuur. Het tegenovergestelde proces van sublimatie kan resublimatie of afzetting worden genoemd. Om sublimatie te laten plaatsvinden, moet materie energie absorberen, dus wordt het beschouwd als een endotherm proces.
Lees ook: Wat zijn de fysieke toestanden van materie?
Samenvatting over sublimatie
Sublimatie is de directe overgang van de vaste fase naar de gasfase, zonder door de vloeibare fase te gaan.
Specifieke omstandigheden van druk en temperatuur zijn nodig om de sublimatie van een stof waar te nemen.
Sublimatie wordt beïnvloed door thermodynamische aspecten, zoals dampdruk in de vaste fase en intermoleculaire interacties.
Sublimatie is een endotherm proces.
Een voorbeeld van sublimatie is wat er gebeurt in droogijs, dat bestaat uit vast koolstofdioxide.
Wat is sublimatie?
sublimatie is de directe overgang van de vaste fase naar de gasfase, zonder door de vloeibare fase te gaan. Het treedt op onder specifieke omstandigheden van temperatuur en druk voor sommige vaste stoffen. Deze overgang is een fysiek proces van toestandsverandering, waarbij geen chemische reacties betrokken zijn.
Het omgekeerde proces, d.w.z. de directe overgang van de gasfase naar de vaste fase, wordt ook wel genoemd. Sommige auteurs gebruiken het woord sublimatie voor deze faseverandering, terwijl anderen "resublimatie" en zelfs "afzetting" gebruiken.
Hoe sublimatie werkt
Er kan een parallel worden getrokken tussen sublimatie en verdamping. In beide gevallen is het eindpunt gas fase. Het verschil zit hem natuurlijk in de beginfase: vast voor sublimatie en vloeibaar voor verdamping.
In beide gevallen, er is invloed van druk devapor en ook thermodynamische aspecten, waarbij warmte en intermoleculaire interacties betrokken zijn.
Wat is dampspanning?
In een gesloten container die een vloeistof bevat, is het mogelijk om waar te nemen dat er een evenwicht is tussen de vloeibare fase en de dampfase. Dit gebeurt omdat, zelfs onder de kooktemperatuur, de aanwezige energie voldoende is om sommige moleculen van de vloeistof los te laten en in de damp over te gaan. Sommige dampmoleculen kunnen echter ook weer condenseren en terugkeren naar de vloeibare fase, wat de omkeerbaarheid van het proces aantoont.
Deze damp, gemaakt van materie (heeft massa en volume), opdrachten druk op het oppervlak van de vloeistof, bekend als dampdruk. Het is niet afhankelijk van de hoeveelheid vloeistof, maar van de temperatuur, want hoe hoger de temperatuur, hoe gemakkelijker de moleculen loskomen van de vloeibare fase.
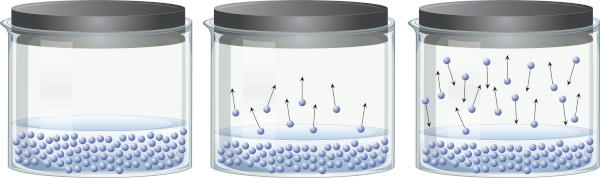
Vloeistoffen die bij gewone temperaturen een hoge dampdruk hebben, worden vluchtig genoemd. Bij 25°C heeft ethylether bijvoorbeeld een dampdruk van 0,58 atm, aceton (propanon) heeft een dampdruk van 0,29 atm en water heeft een dampdruk van 0,023 atm. Trouwens, als de dampdruk gelijk is aan de atmosferische druk, kookt de vloeistof. Klik voor meer informatie over dampdruk hier.
Dampdruk en sublimatie
Hoewel in mindere mate vaste stoffen hebben ook dampdruk, maar veel lager dan die van vloeistoffen. Zelfs bij een temperatuur van 1000 K is de dampdruk van ijzer bijvoorbeeld slechts 9,21 x 10-20 Geldautomaat. Sommige vaste stoffen slagen er echter in om sublimatie te ondergaan, zoals jodium, wat een hogere dampdruk oplevert bij normale temperaturen (4 x 10-4 Geldautomaat).
Dit is alleen mogelijk door de passage van moleculen van de vaste toestand rechtstreeks naar de gasvormige toestand. Om dit te laten gebeuren, de moleculen van de vaste stof moeten aanwezig zijn intermoleculaire interacties zwak (in jodium zijn ze bijvoorbeeld van het type geïnduceerde dipool-geïnduceerde dipool).
Dat is ook te zien het sublimatieproces is endotherm, dat wil zeggen dat de moleculen van de vaste stof energie in de vorm van warmte moeten absorberen, zodat ze de intermoleculaire interacties kunnen verbreken en kunnen overgaan naar de damptoestand. De hoeveelheid warmte die daarbij betrokken is, kan worden gemeten met een thermodynamische grootheid die bekend staat als de enthalpie van sublimatie.
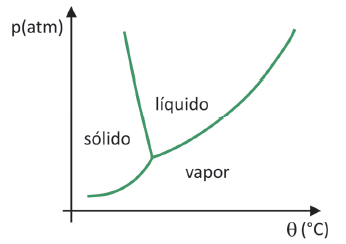
Fasen diagram
Naar om te weten in welk bereik van druk en temperatuur de sublimatie van een vaste stof zal plaatsvinden, moet u uw fasediagram evalueren. Laten we eens kijken naar het geval van koolstofdioxide, CO2.

In een fasediagram brengen de grenslijnen tussen toestanden (vast, vloeibaar en gas) de druk- en temperatuurwaarden samen voor er vindt een staatsverandering plaats. Bij het observeren van het geval van CO2 valt op dat bij een druk van 1 atmosfeer de vaste fase direct overgaat in de dampfase bij een temperatuur van -78,5 °C, wat een sublimatie kenmerkt.
Koolstofdioxide heeft pas een vloeibare fase bij drukken boven 5,11 atmosfeer en daarboven is sublimatie niet meer mogelijk. Klik voor meer informatie over het fasediagram hier.
voorbeelden van sublimatie
Droog ijs: droogijs, vaak gebruikt om misteffecten te maken op feesten en evenementen, is eigenlijk koolstofdioxide in vaste toestand.

mottenballen: mottenballen zijn gemaakt van naftaleen, een aromatische organische verbinding. Het wordt toegepast om slechte geuren te verwijderen en ook om motten, kakkerlakken en andere giftige dieren weg te jagen, daarom is het gebruikelijk dat ze in kasten of zelfs urinoirs worden gebruikt.

Kamfer: Met een karakteristieke geur kunnen kamferkiezels ook sublimatie ondergaan. Ze dienen ook om muggen weg te jagen en schimmel te voorkomen.

Jodium: ook het niet-metaal dat tot de halogenen behoort, ondergaat sublimatie.

Van de aangeboden stoffen, alleen kooldioxide ondergaat sublimatie onder omgevingsomstandigheden. De anderen kunnen, zelfs met sublimatie, normale fusie ondergaan onder de druk waarin we leven.
Lees ook: Plasma - de vierde toestand van materie
Opgeloste oefeningen over sublimatie
vraag 1
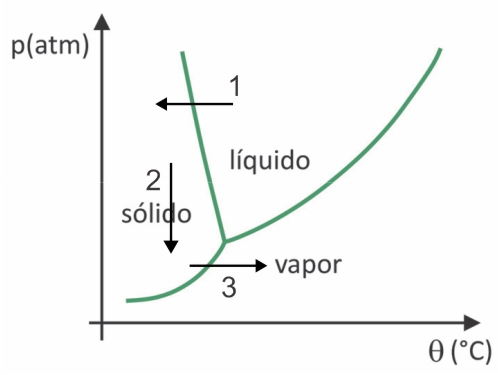
(Fuvest 2020) In supermarkten is het gebruikelijk om zogenaamd gevriesdroogd voedsel te vinden, zoals fruit, groenten en vlees. Gevriesdroogde levensmiddelen zijn na lange tijd nog steeds geschikt voor consumptie, zelfs zonder koeling. De term "gevriesdroogd" in deze voedingsmiddelen verwijst naar het invriesproces en de daaropvolgende uitdroging door watersublimatie. Om watersublimatie te laten plaatsvinden, is een combinatie van omstandigheden vereist, zoals weergegeven in de druk-temperatuurgrafiek, waar de lijnen faseovergangen vertegenwoordigen.
Ondanks dat het een proces is dat industrieel gezien het gebruik van bepaalde technologie vereist, zijn er aanwijzingen dat mensen precolumbianen die in de hoogste regionen van de Andes leefden waren in staat voedsel te vriesdrogen, waardoor het voor meer tijd. Bekijk het alternatief dat uitlegt hoe het natuurlijke vriesdroogproces plaatsvond:
a) Sublimatie van water vond plaats als gevolg van lage temperaturen en hoge atmosferische druk in de bergen.
b) Voedsel werd, nadat het in koude periodes op natuurlijke wijze was ingevroren, naar het laagste deel van de bergen gebracht, waar de atmosferische druk lager was, wat sublimatie mogelijk maakte.
c) Het voedsel werd blootgesteld aan de zon om de temperatuur te verhogen, en de lage lokale atmosferische druk bevorderde het stollen.
d) De temperaturen waren in de koude periodes laag genoeg om voedsel in te vriezen en de lage atmosferische druk in het hooggebergte maakte sublimatie mogelijk.
e) De voedingsmiddelen werden, nadat ze op natuurlijke wijze waren ingevroren, geperst om de druk te verhogen, zodat sublimatie kon plaatsvinden.
Antwoord: Brief D.
Bij vriesdrogen is er het bevriezen van water met de daaropvolgende sublimatie. Precolumbiaanse volken zouden zo'n proces kunnen uitvoeren, omdat in de winter het water zou kunnen bevriezen (pijl 1) en, met de lage druk (pijl 2) van de hoogste regionen van de Andes, zou het sublimatie kunnen ondergaan (pijl 3).
vraag 2
(Uerj 2005) Droogijs, of gestolde kooldioxide, veel gebruikt in koelprocessen, ondergaat sublimatie onder omgevingsomstandigheden. Tijdens deze transformatie treden onder andere de verschijnselen energievariatie en verstoring van interacties op.
Deze verschijnselen worden respectievelijk geclassificeerd als:
a) exotherm - interionisch
b) exotherm - internucleair
c) isotherm - interatomair
d) endotherm - intermoleculair
Antwoord: Brief D.
Sublimatie is een endotherm proces, omdat het absorptie van warmte vereist om de interacties te verstoren die de moleculen in de vaste fase compact houden. Deze interacties zijn van het intermoleculaire type.
Door Stefano Araujo Novais
Scheikundeleraar
