Wetenschapper Friedrich Kohlrausch (1840-1910) was de eerste die suggereerde dat zuiver water elektriciteit geleidt, zij het op kleine schaal. Dit komt omdat water zich amfoterisch gedraagt; dat wil zeggen, bij bepaalde gelegenheden werkt het als zuur en doneert het protonen (H+); en in andere gedraagt het zich als een basis en ontvangt het protonen.
Dit betekent dat water zijn eigen ionisatie uitvoert, volgens de onderstaande chemische vergelijking:
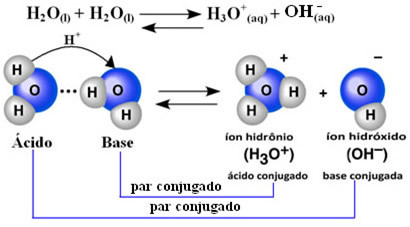
Dit proces heet auto-ionisatie van water en het komt voor op zeer kleine schaal, dat wil zeggen, water is een zeer zwakke elektrolyt, met lage waarden van ionisatiegraad en ionisatieconstante bij evenwicht (Kç). Dit is precies waarom water zo'n lage geleidbaarheid heeft.
Om een idee te krijgen, bij een omgevingstemperatuur van 25°C is het mogelijk om te bepalen dat de concentraties van hydroxide- en hydroniumionen geproduceerd bij de zelfionisatie van zuiver water gelijk zijn aan 1. 10-7 mol. L-1. Dit betekent dat van een miljard watermoleculen er slechts twee ioniseren.
De ionische balansconstante van water wordt genoemd çwaterdissociatieconstante,autoprotolyse constanteof ionisch product van water.Deze constante wordt weergegeven door Kmet wie, omdat de w verwijst naar het woord water, wat in het Engels water betekent.
De berekening ervan wordt op dezelfde manier gedaan als de andere evenwichtsconstanten, onthouden dat, zoals vermeld in de tekst "Constanten van Balance Kc and Kp”, in dit geval verschijnen alleen de producten in de uitdrukking, omdat water in vloeibare toestand dezelfde activiteit heeft naar 1. Zuivere vloeibare of vaste stoffen worden niet in de dissociatieconstante uitgedrukt omdat ze niet veranderen. Alleen waterige en gasvormige oplossingen worden geplaatst. Dus we hebben:
Kmet wie = [H3O+]. [Oh-]
Kmet wie = (1. 10-7). (1. 10-7)
Kmet wie = 10-14
Net als bij de andere evenwichtsconstanten, OKmet wie het verandert alleen met de verandering in temperatuur. Naarmate de temperatuur van water stijgt, neemt ook de ionisatie toe, wat betekent dat de zelf-ionisatie van water een endotherm proces is, dat wil zeggen dat het warmte absorbeert.
Dit is te zien aan de waarden van het ionische product van water (Kmet wie) gegeven in onderstaande tabel bij verschillende temperaturen:
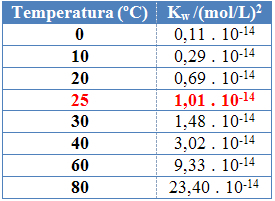
Het ionische product van water heeft altijd een vaste waarde bij elke temperatuur, zowel in zuiver water als in oplossing. Zelfs als de oplossing concentraties H-ionen heeft3O+ en oh- verschillend, zal het product ertussen constant blijven.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm
