DE chroom, atoomnummer 24, is een overgangsmetaal in groep 6 van het periodiek systeem. De kleur is grijsachtig, maar het is ook een zeer glanzend metaal. Het bestaat voornamelijk in de oxidatietoestanden +2, +3 en +6 en heeft de eigenschap dat al zijn verbindingen gekleurd zijn. Geen wonder dat de naam is afgeleid van het Grieks chroma, wat kleur betekent.
Dit element wordt verkregen door chromiet en wordt veel gebruikt in de metallurgische industrie, bij de productie van roestvrij staal en andere speciale legeringen. Chroom kan ook worden gegalvaniseerd op objecten, in een effect dat bekend staat als verchromen, wat naast schoonheid ook een grote chemische weerstand garandeert. Chroomverbindingen worden naast vuurvaste materialen ook gebruikt in pigmenten en verven.
Lees ook: Hafnium — het overgangsmetaal met eigenschappen die vergelijkbaar zijn met zirkonium
chrome samenvatting
Chroom is een grijsachtig, glanzend metaal dat groep 6 van de opent Periodiek systeem.
Het is zeer goed bestand tegen corrosie en chemische aantasting bij kamertemperatuur.
Het presenteert voornamelijk oxidatietoestanden +2, +3 en +6.
Alle verbindingen hebben kleur.
Het kan worden verkregen uit chromiet, FeCr2DE4.
Het wordt voornamelijk geëxploiteerd door de metallurgische industrie, die het gebruikt bij de vervaardiging van: roestvrij staal.
Het werd in 1797 ontdekt door de Fransman Louis Nicolas Vauquelin.
[pullicity_omnia]
chroom eigenschappen
Symbool: Kr.
Atoom nummer: 24.
Atoom massa: 51.9961 c.u.s.
Elektronegativiteit: 1,66.
Fusiepunt: 1907°C.
Kookpunt: 2671°C.
Dikte: 7,15 g.cm-3 (bij 20°C).
Elektronische configuratie: [Lucht] 4s1 3d5.
Chemische serie: groep 6, metais overgang.
chroom kenmerken:
Chroom, atoomnummer 24, is a metaal grijs van kleur, hard en glanzend. Bij kamertemperatuur is het goed bestand tegen chemische aanvallen, zoals van zure of basische oplossingen, met uitzondering van HCl en H2ENKEL EN ALLEEN4 verdund. Bij hogere temperaturen wordt chroom echter veel reactiever en wordt het gemakkelijk geoxideerd door O2, en combineert met halogenen en de meeste niet-metalen.
In oplossing hebben chroomverbindingen de neiging om oxidatiegetallen van +6, +3 en +2 te hebben. In feite is een interessante functie dat: alle de chroomverbindingen zijn gekleurd, zoals het dichromaat van potassium, K2Cr2DE7, wat oranje is, en kaliumchromaat, K2CrO4, die geel is.
Een merkwaardig feit over chroom is dat: de elektronenconfiguratie volgt niet het verwachte patroon. je maken elektronische distributie, zou het naar verwachting [Ar] 4s. zijn2 3d4, echter, energie- en stabiliteitsberekeningen tonen aan dat de [Ar] 4s-configuratie1 3d5 het is stabieler. Dit kan worden verklaard door de De regel van Hund.
Volgens deze regel geldt: hoe groter het aantal elektronen met gelijke (of parallelle) spins in een onvolledige orbitaal, hoe lager de energie van de atoom, dat wil zeggen, hoe groter de stabiliteit. Kijk naar de afbeelding hieronder:
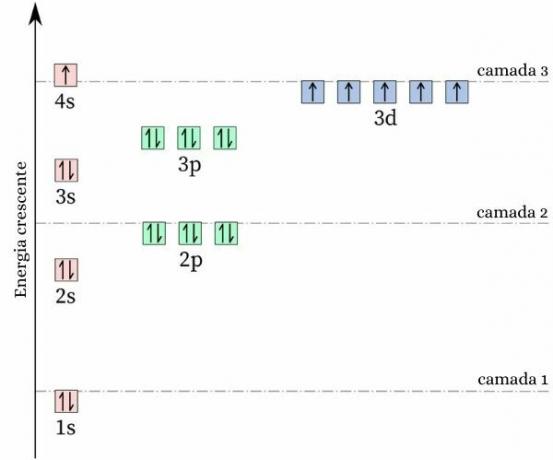
Als Chrome de 4s-configuratie heeft overgenomen:2 3d4, zou de 4s-orbitaal elektronen met tegengestelde spin (↑↓) presenteren, wat de afstoting zou vergroten, er zouden immers twee ladingen van hetzelfde teken zijn die een enkele orbitaal delen.
Door de 4s-configuratie aan te nemen1 3d5, chroom bevat een groter aantal elektronen met gelijke spin, zonder de aanwezigheid van elektronen die dezelfde orbitaal delen (zoals weergegeven in de vorige afbeelding), wat de energie vermindert en meer stabiliteit garandeert.
Zie ook: Vanadium — scheikundig element waarvan de oplossingen ook verschillende kleuren hebben
Waar is chroom te vinden?
chroom is het tiende meest voorkomende element op aarde. Hoewel er verschillende mineralen zijn die chroom in hun samenstelling hebben, zijn chromiet, FeCr2DE4, is het belangrijkste mineraal van chroom en wordt commercieel het meest geëxploiteerd.

Het is belangrijk om te benadrukken dat de landen met de hoogste chroomreserves zijn:
Zuid-Afrika;
Kazachstan;
India;
Kalkoen.
DE Brazilië is de enige chroomproducent op het hele Amerikaanse continent, maar bezit slechts 0,11% van de wereldreserves. De reserves worden voornamelijk verdeeld in de volgende staten:
Bahia;
amapá;
Minas Gerais.
Het chroom krijgen

DE metallisch chroom wordt geproduceerd door van chromiet. In dit geval wordt het mineraal gesmolten met natriumcarbonaat, Bij2CO3, in aanwezigheid van lucht, waarbij natriumchromaat en ijzer III-oxide ontstaan:
4 FeCr2DE4 + 8 inch2CO3 + 7 O2 → 8 in2CrO4 + 2 Fe2DE3 + 8 CO2
Van daaruit wordt extractie uitgevoerd met Water, aangezien de Na2CrO4 is oplosbaar in water, terwijl Fe2DE3 niet. Vervolgens wordt het medium aangezuurd met H2ENKEL EN ALLEEN4, waardoor de kristallisatie van het chromaat van natrium. dan een2CrO4 wordt gereduceerd tot chroom III-oxide met behulp van koolstof bij hoge temperatuur:
Bij2CrO4 + 2 C → Cr2DE3 + aan2CO3 + CO
Metallisch chroom wordt dan verkregen wanneer aluminium als reductiemiddel wordt gebruikt, ook bij hoge temperatuur:
Cr2DE3 + 2 Al → Al2DE3 + 2 Cr
chrome toepassingen
DE industrie metallurgisch is de grootste verbruiker van chroom, met ongeveer 80% van al het geproduceerde chroom, hetzij in de vorm van chromiet of Cr-concentraat.2DE3. Dit komt omdat chroom in staat is om de ferrochroomlegering te vormen, de basisbron voor het verkrijgen van: roestvrij staal en andere speciale legeringen.
Chroom, dat typisch 18% van roestvrij staal uitmaakt, verhoogt de weerstand tegen oxidatie (corrosie) en andere chemische aanvallen op staal aanzienlijk. In andere speciale legeringen speelt chroom ook een rol bij het verhogen van de hardbaarheid, hardheid en taaiheid van materialen.

DE vuurvaste industrie Het is ook een goede verbruiker van chroom, aangezien chromiet een bekend vuurvast materiaal is, dat wil zeggen een materiaal dat bestand is tegen de thermische, chemische en fysische effecten die zich in industrieën voordoen. Chromiet, dat wordt gebruikt voor de vervaardiging van vuurvaste stenen, is zeer goed bestand tegen degradatie bij blootstelling aan verwarming.
al de chemische industrie probeert chroom op verschillende manieren te gebruiken:
als katalysator;
als corrosieremmer;
in verchromen;
in pigmenten;
in kleurstoffen.
Verchromen is algemeen bekend, bestaande uit de vorming van een beschermende laag chroom over een object, waardoor het wordt beschermd tegen corrosie. Hierbij wordt chroom afgezet op het te verchromen object elektrolyse chroom III sulfaat, Cr2(ENKEL EN ALLEEN4)3, geproduceerd door de ontbinding van Cr2DE3 in H2ENKEL EN ALLEEN4.
Chroompigmenten zijn heel gebruikelijk, vooral met de verschillende kleuren die met hun verbindingen kunnen worden verkregen. Bij het oplossen van chroom III chloride hexahydraat, CrCl3·6 uur 's ochtends2O, een violette oplossing wordt verkregen. Aan de andere kant, bij het oplossen van chroom III-sulfaat, Cr2(ENKEL EN ALLEEN4)3, wordt een groene kleur verkregen.
De oplossing van chroom II-chloride, CrCl2, is blauw, terwijl chroom II-acetaat, Cr2(COO)4, is een rode vaste stof. Chroomoxide II, CrO2, het is zwart; kaliumchromaat, K2CrO4, en geel; kaliumdichromaat, K2Cr2DE7, en oranje; kaliumtrichromaat, K2Cr3DE10, het is rood; en chroom VI-oxide, CrO3, is ook rood.
Interessant:De robijnen zijn eigenlijk edelstenen, met de formule Al2DE3, die sporen van chroom in hun constitutie hebben. Dit is ook het geval met smaragd, een vorm van beryl, waarvan de groene kleur het resultaat is van kleine hoeveelheden chroom.
Weet ook:Tungsten - een grijsachtig metaal waarvan de kleur lijkt op staal
De relatie van Chromium tot gezondheid
Twee oxidatietoestanden van chroom spelen een biologische rol. Laten we eens kijken.
→ Zeswaardig chroom (Cr6+)
Met betrekking tot Cr6+, het is bekend dat het kan beschouwd als kankerverwekkend, vooral bij inademing of inname in grote hoeveelheden.
→ Driewaardig chroom (Cr3+)
Driewaardig chroom is altijd geweest beschouwd een essentieel element. Voedingssuppletie van chroom in deze vorm is populair geworden voor de bevordering van essentiële sporenelementen en als middel om gewicht te verliezen. Er is ook een discussie dat de toediening van driewaardig chroom interessant zou zijn voor de behandeling van type 2 diabetes, evenals voor zwangerschapsdiabetes.
Hoewel, sommige auteurs zeggen deze essentie ter discussie. De gedachtegang is dat chroom, al dan niet aangevuld, geen verschil maakt voor de lichaamssamenstelling, metabolisme geeft glucose of insulinegevoeligheid. Er wordt aangenomen dat de hoogste dosering chroom in feite farmacologische en niet-nutritionele effecten heeft om aan te geven dat het een essentieel element is.
chrome geschiedenis
De naam chroom komt van het Grieks chroma, wat kleur betekent. Na ook de naam aan dit element te hebben gegeven, zijn ontdekking kwam tot standFranse apotheker en chemicus Louis Nicolas Vauquelin, in het jaar 1797, toen hij chroom opmerkte bij het bestuderen van het crocoite-erts, PbCrO4. Aanvankelijk was het metaal echter geen groot commercieel succes.
Vijftien jaar na zijn ontdekking wist Sir Humphry Davy bijvoorbeeld niet veel over chroom en zijn verbindingen toen hij zijn beroemde boek schreef Elementen van chemische filosofie, wat alleen aangeeft dat chroomzuur een zure smaak had.
In hetzelfde jaar schreef Jöns Jacob Berzelius dat de nasmaak van giftig chroomzuur onaangenaam en metaalachtig was. Berzelius realiseerde zich dat het metaal, hoewel bros, behoorlijk resistent was tegen de werking van zuren en atmosferische lucht.
Hoewel aanvankelijk geen groot commercieel succes, aan het einde van de 19e eeuw en het begin van de 20e eeuw, het element begon commercieel te worden gebruikt, toen roestvrij staal op grote schaal werd gebruikt, evenals het verchromen van onderdelen in de auto-industrie, waardoor chroom een metaal was waar veel vraag naar was.
Niet stoppen nu... Er is meer na de advertentie ;)
Chroom opgeloste oefeningen
vraag 1
(UEFS/BA)Het chroomatoom heeft een oxidatiegetal van +3 in de soort
A) Cr2DE3
B) CrO
C) Cr
D) CrO42-
E) Cr2DE72-
Oplossing:
alternatief A
In de letter C komt chroom voor als een eenvoudige stof, dus in dat geval de NOx gelijk is aan nul.
DE zuurstof in de andere verbindingen komt het voor met NOx gelijk aan -2. We kunnen dus de NOx van chroom in alle soorten berekenen, waardoor het de onbekende wordt (x):
Cr2DE3 → 2x + 3(-2) = 0 ⸫ x = +3
CrO → x + (-2) = 0 ⸫ x = +2
CrO42- → x + 4(-2) = -2 ⸫ x = +6
Cr2O72- → 2x + 7(-2) = -2 ⸫ x = +6
vraag 2
(UPE 2013) Een internationale groep wetenschappers heeft een complexe chemische reactie ontdekt die verantwoordelijk is voor de achteruitgang van sommige van de grote kunstwerken uit de geschiedenis, gemaakt door Vincent van Gogh (1853-1890) en andere beroemde schilders in de 20e eeuw XIX. In hun onderzoek hebben deze onderzoekers de pigmenten kunstmatig verouderd en ontdekten dat de verdonkering van de toplaag was gerelateerd aan een verandering van chroom aanwezig in de verf van Cr(VI) naar Cr(III).
Beschikbaar in: http://agencia.fapesp.br/13455 (Aangepast)
Gegevens:Cr (Z = 24), elektronische configuratie: [Ar] 4s1 3d5
Gezien de hierboven beschreven situatie is het JUISTbeweren dat (de)
A) oxidatie van Cr(VI) tot Cr(III) heeft grote artistieke werken in de geschiedenis aangetast.
B) veroudering van de frames is gerelateerd aan de elektronische excitatie van CuDe voor Cr3+.
C) Cr-reductieproces:6+ voor Cr3+ heeft beroemde werken van de 19e eeuw verduisterd.
D) de transformatie die heeft plaatsgevonden heeft de Cu. geoxideerdDe, verantwoordelijk voor de glans van het originele schilderij.
E) verandering van Cr(VI) naar Cr(III) is een chemische reactie die pas na vele jaren plaatsvindt.
Oplossing:
alternatief C
De overgang van Cr(VI) naar Cr(III) is een proces van afname (afname van NOx), die verantwoordelijk was voor de verduistering van de schermen.
Door Stefano Araújo Novais
Scheikundeleraar

