DE rutherfordium is een synthetisch element met atoomnummer 104, behorend tot groep 4 van de Periodiek systeem, zijnde het eerste lid van de transactinide-reeks. De eerste detectie dateert van 1964, in de beroemde laboratoria van de stad Dubna. Net als andere transactiniden was de officiële naam van element 104 betrokken bij een conflict tussen de Sovjets en de Amerikanen, in een stuk uit de Koude Oorlog in de geschiedenis van de chemie.
het rutherfordium heeft geen praktische toepassingen, aangezien de meest stabiele isotoop ongeveer twee en een half uur heeft halveringstijd. Studies in gasvormige systemen en oplossingen bewijzen echter de chemische gelijkenis met de andere elementen van groep 4, zoals zirkonium en hafnium.
Lees ook: Seaborgium - synthetisch element vernoemd naar wetenschapper Glenn Seaborg
Samenvatting van Rutherfordium
- Het is een synthetisch chemisch element in groep 4 van het periodiek systeem.
- Het werd voor het eerst gesynthetiseerd in 1964 in het Joint Institute for Nuclear Research in Dubna, Rusland.
- Het is een radioactief elementgrootmoeder.
- Net als andere transactiniden lijdt rutherfordium aan een lage stabiliteit en is het moeilijk om aanzienlijke monsters voor studies te synthetiseren.
- De naam werd pas in 1997 officieel gemaakt, na meerdere jaren van onenigheid tussen de Amerikanen en de Sovjets.
Rutherfordium eigenschappen
- Symbool: Rf
- atoomnummer: 104
- atoom massa: 267 k.u.s.
- Elektronische configuratie: [Rn] 7s2 5f14 6d2
- meest stabiele isotoop: 267Rf (2,5 ± 1,5 uur halfwaardetijd)
- chemische reeks: groep 4, transactiniden, superzware elementen
Kenmerken van Rutherfordium
Zoals alle transactiniden, d.w.z. elementen net na Laurence (Lr), rutherfordium is een radioactief element. Zijn meest stabiele isotoop werd ontdekt in 2004 en zijn halfwaardetijd (de tijd die nodig is voor de hoeveelheid radio-isotoop halveren) is twee en een half uur, met een foutmarge van anderhalf uur min of meer.
De grote moeilijkheid bij het vaststellen van de chemische eigenschappen van rutherfordium en andere transactiniden is in het algemeen het feit dat er een lage productiesnelheid is, zowel in hoeveelheid als in snelheid. In deze elementen is het bijvoorbeeld heel gebruikelijk om slechts één enkele atoom, wat in zekere zin aanpassingen vereist in termen van berekeningen, aangezien de meeste vergelijkingen worden opgesteld voor systemen met meer dan één atoom. Verder zijn vaak de isotopen hebben een zeer korte halfwaardetijd, wat diepgaander onderzoek moeilijk of zelfs onmogelijk maakt.
In het specifieke geval van Rf zijn wetenschappers er al in geslaagd te bewijzen dat het gedrag in vloeibare fase vergelijkbaar is met dat van andere elementen. lichtere groep 4, zirkonium en hafnium, zoals bij de vorming van fluoriden in oplossing met daaropvolgende extractie in ionenuitwisselingsharsen. Dit gedrag hielp de aanwezigheid van rutherfordium in groep 4 van het periodiek systeem te versterken.
Lees ook: Nieuwe chemische elementen — de vier ontbrekende elementen in de 7e periode
Rutherfordium verkrijgen
Transactiniden hebben een grote infrastructuur nodig voor hun productie. Allemaal zijn gesynthetiseerd met deeltjesversnellers, waarin ionische soorten botsen met zware elementen. De detectie van deze elementen is ook niet eenvoudig en duidelijk.
Wanneer gevormd, begint het radioactieve element van nature te vervallen en vertoont het emissies, zoals alfa- en bètadeeltjes. Vaak is het nodig om de radioactief verval van het gevormde atoom of identificeer zelfs atoomsoorten die kunnen ontstaan uit deze kernreacties, zoals in een puzzel.
Tel daarbij op dat de halfwaardetijden van transactinide-isotopen vaak kort zijn, in het bereik van seconden, waardoor het alleen mogelijk is om een hoeveelheid te verkrijgen in het bereik van een paar atomen of zelfs een enkele atoom.
In het geval van Rf omvatte de eerste synthese die voor dit element werd gerapporteerd de botsing van plutoniumisotopen, Pu, met ionen van neonisotoop 22, Hè.
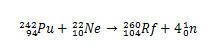
Andere isotopen van rutherfordium kunnen echter worden geproduceerd door de soorten die zullen botsen te wijzigen. Isotoop 261 kan bijvoorbeeld worden geproduceerd door de reactie tussen zuurstof-18 en curium-248, waarbij vijf neutronen worden geproduceerd.
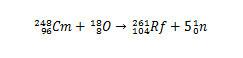
Check het in onze podcast: Hoe werkt een deeltjesversneller?
Voorzorgsmaatregelen met Rutherfordium
Aangezien rutherfordium niet eens op grote schaal kan worden geproduceerd, zijn de risico's van dit element gekoppeld aan de effecten van straling. In een gecontroleerd laboratorium worden deze risico's echter geanticipeerd en dus geminimaliseerd.
Geschiedenis van Rutherfordium

Alle transactiniden waren in de jaren zestig en zeventig betrokken bij een race om hun ontdekking. Deze aflevering wordt gerapporteerd als de War of Transfers, een stukje van de Koude Oorlog in de geschiedenis van de chemie. Ondanks dat het zo werd genoemd, wat suggereert dat de geschillen plaatsvonden over elementen na fermium, een element atoomnummer 100, de direct betrokken elementen waren 104 tot 109, de nieuw ontdekte transactiniden.
In het geval van Rutherfordium begon het geschil in 1964., toen Sovjetonderzoekers van het Gezamenlijk Instituut voor Nucleair Onderzoek in de stad Dubna Rusland meldde de ontdekking van element 104 isotoop 260 door plutonium-242 te bombarderen met ionen neon-22. Maar de Dubna-onderzoekers presenteerden slechts één bewijs, en dat was de detectie van een isotoop die spontaan is vergaan, zonder duidelijk de massa en de tijd van te identificeren halveringstijd. Als gevolg hiervan werd de vondst met argwaan bekeken.
Vijf jaar later, in 1969, kwam een team van Amerikaanse wetenschappers van het Lawrence Berkeley National Laboratory in Berkeley, Californië, onder leiding van Albert Ghiorso, zei dat hij voldoende bewijs heeft geleverd voor de ontdekking van element 104 isotoop 257 door californium-249 te laten botsen met koolstof-12. Dezelfde wetenschappers waren later in staat om de isotoop 259 van element 104 te produceren. In 1973 bevestigden wetenschappers van het Oak Ridge National Laboratory onafhankelijk de atoomnummer 104 voor de massa 257 isotoop geproduceerd in Berkeley.
De volgende jaren waren een groot geschil tussen de wetenschappers van de twee landen, totdat in 1985 de... of Pure and Applied Chemistry (IUPAC) en de International Union of Pure and Applied Physics (IUAP) vorm een gemengde commissie van negen wetenschappers, genaamd de Transfers Working Group (Transfermium Werkgroep of TWG). De TWG is opgericht om te beslissen wie daadwerkelijk verantwoordelijk was voor de ontdekkingen van elementen variërend van 101 tot 112.
Toch waren de beslissingen van de TWG niet altijd zonder twijfel. In het geval van element 104 heeft de werkgroep besloten dat de Krediet moet worden gedeeld tussen Sovjet- en Amerikaanse wetenschappers, iets dat Berkeley-wetenschappers helemaal niet leuk vonden.
In 1991 beweerden Ghiorso en Seaborg, van het Berkeley-team zelfs dat de identificatie van element 104 door de Dubna-wetenschappers was duidelijk verkeerd en ontkende op een gegeven moment de geldigheid van de conclusies van TWG, omdat ze ze een slechte dienst aan de gemeenschap beschouwden wetenschappelijk.
Geen wonder, in Begin jaren negentig bestond er nog geen consensus over de namen voor de nieuwe elementen.. Er waren toen onderhandelingen met Duitse, Russische en Amerikaanse wetenschappers, die gefrustreerd bleken te zijn. Daar, in 1992, stelde het Duitse laboratorium Gesellschaft für Schwerionenforschung (GSI) namen voor elementen 102 tot en met 109 voor, waarbij meitnerium voor element 104 werd geplaatst.
Toch werd de lijst, ondanks lof, niet aanvaard door de betrokken wetenschappers. Het besluit zou in 1994 kunnen worden genomen, tijdens de conferentie van de Iupac Inorganic Compound Nomenclature Commission (CNIC). Daarin werd de naam dubnium gekozen voor element 104, maar de American Chemical Society nam in hetzelfde jaar de naam rutherfordium aan voor het element 104. element 104, in een moment van diskrediet van de kant van de Amerikanen, die de autoriteit van de IUPAC in twijfel kwamen trekken om nieuwe namen.
alleen in 1997, op de algemene IUPAC-conferentie in Genève, is dat: element 104 werd eindelijk officieel gemaakt als rutherfordium, nadat de ACS plaats had gemaakt voor de nomenclatuur van andere nabijgelegen elementen.
Oefeningen opgelost op rutherfordium
vraag 1
Rutherfordium is een synthetisch element en een van de grootste moeilijkheden bij het bestuderen ervan is het feit dat het niet mogelijk is om grote hoeveelheden ervan te synthetiseren.
Onder de mogelijke factoren die bijdragen aan deze moeilijkheid, kunnen we aangeven:
(A) Rutherfordium heeft isotopen met een lange halfwaardetijd in de orde van miljoenen jaren.
(B) Rutherfordium vervalt spontaan en zeer snel, waardoor detectie van zijn macroscopische hoeveelheden wordt voorkomen.
(C) Er zijn geen technologieën die rutherfordium kunnen synthetiseren, aangezien hun gegevens strikt theoretisch en zonder wetenschappelijke basis zijn.
(D) De wetten van de chemie stellen dat het onmogelijk is om elementen te synthetiseren waarvan het atoomnummer dat van lawrence overschrijdt, 103.
(E) Tijdens de synthese van rutherfordium krijgen lichtere elementen van zijn groep chemisch prioriteit.
Antwoord: letter B
Transactinide-elementen, zoals Rf, zijn radioactief en vervallen spontaan met hoge snelheid, omdat hun halfwaardetijd kort is. Zo zijn er aan het einde van het experiment nog maar weinig atomen over van de synthetische soort.
vraag 2
In 1964 beweerden onderzoekers uit Dubna de isotoop-260 van rutherfordium (Z = 104) te hebben gesynthetiseerd. In het geval van deze isotoop, wat is het aantal neutronen?
(A) 104
(B) 260
(C) 151
(D) 156
(E) 161
Antwoord: letter D
Het aantal neutronen (n) kan worden berekend met behulp van het massagetal (A) en het atoomnummer (Z), door de volgende vergelijking:
A = Z + n
Vervangend hebben we:
260 = 104 + n
n = 260 - 104
n = 156
afbeelding tegoed
[1] rozen abbas / rolluiken
Door Stefano Araújo Novais
Scheikundeleraar
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/rutherfordio-rf.htm

