DE pastaatoom, zoals de naam al doet vermoeden, is het de massa van een atoom, meestal gesymboliseerd door "mDe” of “MA”. Omdat het atoom echter een extreem kleine entiteit is, onzichtbaar voor menselijke ogen, is het niet mogelijk om de massa ervan te meten met bijvoorbeeld schalen. Dus wetenschappers bepaalden de massa van atomen door ze te vergelijken met de massa's van andere atomen.
Dit gebeurt ook met de andere eenheden. De eenheid van massa is bijvoorbeeld de standaard kilogram, wat overeenkomt met een cilinder met een hoogte en diameter van 3,917 cm, gemaakt van 10% iridium en 90% platina. Het dient dus als vergelijking. Als we bijvoorbeeld een object op een weegschaal "wegen" en we vinden dat de massa 10 kg is, betekent dit dat de massa 10 keer groter is dan de gekozen standaard: 1 kg.
Niet stoppen nu... Er is meer na de reclame ;)
Hetzelfde geldt voor atomen. De gekozen standaard was koolstof-12, en dit atoom kreeg willekeurig een massa van 12 u toegewezen. De "u" is de eenheid van atomaire massa en is daarom gelijk aan 1/12 van de massa van een koolstofatoom.
Als we bijvoorbeeld zeggen dat de atoommassa van waterstof gelijk is aan 1 u, betekent dit dat het is alsof als we de koolstof in 12 delen verdelen, is de massa van een van deze delen gelijk aan de massa van het atoom van waterstof. Een ander voorbeeld is zwavel, de atoommassa is 32 u, wat betekent dat de massa 32 keer groter is dan 1/12 van de massa van 12C.
1 u = 1/12 van de massa van 1 koolstofatoom 12

De atomaire massa-eenheid is 1/12 van de massa van koolstof-12
De molecuulmassa van stoffen is de som van de atoommassa's van de elementen. De atoommassa van zuurstof is bijvoorbeeld gelijk aan 16 u, dus de molecuulmassa van het zuurstofgasmolecuul (O2) is gelijk aan 32u.
Omdat laboratoriumtechnieken momenteel zeer geavanceerd zijn, zijn er apparaten die de atomaire massa van elementen nauwkeurig meten, zoals de massaspectrometer. Het is dus mogelijk om te weten dat 1 u is gelijk aan 1.66054. 10-24 G.
Mindmap: Atoommassa

*Om de mindmap in PDF te downloaden, Klik hier!
Omdat atomaire massa's met grote precisie worden bepaald, worden ze in het periodiek systeem weergegeven in de vorm van decimale getallen. Maar als we gaan rekenen, gebruiken we meestal het afgeronde getal, met uitzondering van experimenten die heel precies moeten zijn. Als u bijvoorbeeld naar het periodiek systeem kijkt, ziet u dat de atomaire massa van zuurstof gelijk is aan 15.999 u, maar over het algemeen gebruiken we de waarde 16 u in de berekeningen. Dit gebeurt ook met koolstof, waarvan de atoommassa wordt gegeven door 12.01 u, zoals hieronder weergegeven:
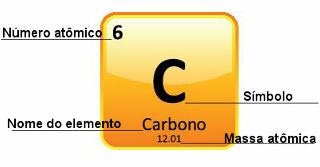
Vertegenwoordiging van koolstof in het periodiek systeem
De elementen die in het periodiek systeem voorkomen, zijn eigenlijk het gewogen gemiddelde van alle natuurlijke isotopen van het element. De atomaire massa die in de tabel wordt weergegeven, is dus ook het gemiddelde van de atomaire massa's van deze elementen. Chloor (C?) heeft bijvoorbeeld twee natuurlijke isotopen, 35 en 37, waarvan de respectievelijke percentages in de natuur 75,76% en 24,24% zijn. De atoommassa's van elk van deze isotopen zijn verschillend, waarbij die van C?-35 34,96885 u is en die van C?-37 36,96590.
Op deze manier wordt de atomaire massa van het element berekend, rekening houdend met de massa van elke isotoop en de overvloed waarmee het in de natuur voorkomt. In het geval van chloor hebben we:
Atoommassa van het element chloor = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Atoommassa van het element chloor = 35,45
Dit is de atomaire massawaarde van chloor die in het periodiek systeem voorkomt.
* Mindmap door mij Diogo Lopes
Door Jennifer Fogaça
Afgestudeerd in Letters

