Onder de intermoleculaire krachten, de geïnduceerde dipool-geïnduceerde dipoolkrachten zij zijn de enige die niet zijn bestudeerd door de Nederlandse natuurkundige Johannes Diederik Van der Waals (1837-1923). Ze werden opgehelderd door de Duitse natuurkundige Fritz Wolfgang London (1900-1954), dus deze krachten worden ook wel londen strijdkrachten of londen dispersiekrachten. Een andere naam die aan deze krachten wordt gegeven is instantane dipool-geïnduceerde dipool.
Dit soort kracht treedt op in niet-polaire stoffen, zoals onder andere H2, O2, F2, Cl2, CO2, CH4 en C2H6. En ze kunnen ook voorkomen tussen edelgas atomen, wanneer ze naderen, waardoor afstoting tussen hun elektrosferen ontstaat. Op deze manier hopen de elektronen zich op aan een bepaalde kant, die negatief gepolariseerd is en de andere kant positief, vanwege het negatieve ladingstekort.
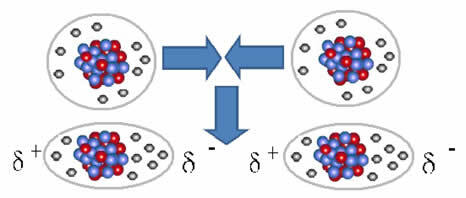
Niet-polaire moleculen kunnen van een gasvormige toestand – waarin ze heel ver uit elkaar liggen en er geen interactie is, omdat er geen polen zijn – naar een vloeibare en vaste toestand. In deze aggregatietoestanden zijn de moleculen dichterbij en de elektronische aantrekkingen of afstotingen tussen hun elektronen en kernen kunnen tijdelijk leiden tot een vervorming van hun elektronische wolken, waardoor positieve en negatieve polen ontstaan tijdelijk.
Onmiddellijke dipolen kunnen polarisatie van naburige moleculen induceren, wat resulteert in aantrekkende krachten.
Niet stoppen nu... Er is meer na de reclame ;)
Deze inductie kan ook optreden. tussen verschillende moleculen en in het algemeen deze krachten zijn zwakker in intensiteit dan de dipool-dipool- en waterstofbindingssterkten. Daarom zijn vaste stoffen met deze interactiesterkte zoals droogijs (kooldioxide - CO2) en jodium (I2), die zich in de vaste toestand bevinden, subliem (ga naar de gasvormige toestand); omdat de energie die nodig is om hun interacties te verstoren klein is.
Een voorbeeld van intermoleculaire krachten tussen polaire en niet-polaire moleculen doet zich voor tussen zuurstofgas (niet-polair) en water (polair). Het blijkt dat het negatieve uiteinde van het water de O2 nadert, zichzelf afstoot, en dus beweegt de elektronische wolk van het niet-polaire molecuul weg. De zuurstof is dan tijdelijk gepolariseerd en begint te interageren met het water, waardoor het oplosbaar wordt.
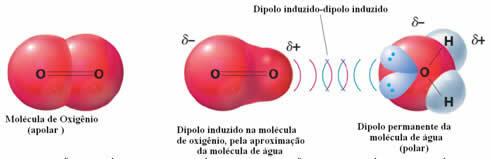
Omdat deze krachten zwak zijn, is de oplosbaarheid van dit gas in water klein. Toch is de aanwezigheid ervan essentieel om het leven van verschillende waterorganismen te behouden.
Deze interactiekracht komt ook in de natuur voor en zorgt voor hechting tussen de poten van de gekko's en het oppervlak waarop ze lopen. Daarom kunnen ze over muren en plafonds lopen zonder te vallen of te plakken.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Brazilië School Team
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijk:
FOGAÇA, Jennifer Rocha Vargas. "Geïnduceerde dipool-geïnduceerde dipool- of Londense dispersiekrachten"; Braziliaanse School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/forcas-dipolo-induzido-dipolo-induzido-ou-dispersao-london.htm. Betreden op 27 juli 2021.


