De reacties van toevoeging zijn belangrijke acties met betrekking tot organische syntheses, omdat hierdoor een interessant aantal organische stoffen kan worden ontwikkeld.
Om de additiereactie te laten plaatsvinden, is het noodzakelijk om twee bindingsplaatsen in de koolstofketen te creëren, wat eenvoudig gebeurt wanneer de keten onverzadigd is (aanwezigheid van pi-link). Dus wanneer de pi-link wordt verbroken, verschijnen de sites in de keten.
Een groep stoffen die naast syntheses kan worden gebruikt, is: cycloalkanen of cyclanen, groep koolwaterstoffen met cyclische en verzadigde ketens. Ze ontsnappen aan de algemene regel van optellen omdat ze geen pi-link hebben, maar afhankelijk van bepaalde voorwaarden (warmte, katalysatormetaal, zuur medium) ze kunnen een kettingbreuk ondergaan tussen twee koolstofatomen, waardoor er twee bindingsplaatsen verschijnen om de toevoeging te laten plaatsvinden. Er is echter een feit dat het gebruik van deze verbindingen beperkt. Het feit is de oproep ringspanningstheorie, voorgesteld door Adolf V. Bayer in 1885.
Om de sigmabinding tussen de koolstoffen te verbreken, moet er een zekere instabiliteit tussen de koolstoffen zijn. Deze instabiliteit is gerelateerd aan de hoek van bindingen tussen koolstoffen. Volgens Bayer is de hoek die zorgt voor a grote stabiliteit voor de sigma-link is 109,47O. Dus kettingen met een hoek tussen koolstofatomen kleiner dan 109,47O ze hebben de neiging om instabiliteit te hebben in de sigma-bindingen tussen de koolstoffen die de ketens vormen, wat hun breuk bevordert in combinatie met een ideale externe toestand.
De enige cycloalkanen met een hoek kleiner dan 109,47O onder de koolstoffen zijn: cyclopropaan (60O), cyclobutaan (90O) en cyclopentaan (108O). Cyclopentaan heeft een hoek die zeer dicht bij 109,47. ligtO het heeft zeer stabiele sigma-bindingen, daarom kan het geen additiereactie ondergaan. Hieronder hebben we de structuren van deze drie cycloalkanen:

Structuurformule van respectievelijk cyclopropaan, cyclobutaan en cyclopentaan
observatie: Elke cycloalkaan met meer dan 5 koolstofatomen in de keten zal een substitutiereactie uitvoeren voor voorbeeld, en nooit een toevoeging omdat de sigmabindingen tussen hun koolstofatomen extreem zijn stal.
De additiereacties die kunnen optreden met cycloalkanen zijn in principe alle, maar met cyclopentaan zijn de enige die het kan ondergaan hydrogenering en halogenering. Hieronder staan voorbeelden van toevoegingen met cycloalkanen en hun omstandigheden:
a) Hydrogenering
Reactie van het cycloalkaan met het waterstofmolecuul met de aanwezigheid van een metallische katalysator in poedervorm (zink, nikkel of platina) in aanwezigheid van verwarming (rond 180°C)OC). Bij deze reactie zal het cycloalkaan aanleiding geven tot a alkaan. In deze reactie wordt, nadat de cyclus is verbroken, één waterstofatoom toegevoegd aan elk van de koolstofatomen van de sigma-binding die is verbroken.

Toevoegingsreactie in cyclobutaan met waterstof
b) Halogenering:
Reactie van het cycloalkaan met het halogeenmolecuul (bijvoorbeeld chloor, broom, jodium) met de aanwezigheid van ijzer III-chloridekatalysator (FeCl3). Bij deze reactie zal het cycloalkaan aanleiding geven tot a organisch halide met twee halogeenatomen in de keten. Nadat de cyclus is verbroken, hebben we de toevoeging van een halogeenatoom op elk van de koolstofatomen van de sigma-binding die was verbroken.

Toevoegingsreactie in cyclobutaan met broom
c) Reactie met halogeenhydriden (zuurhalogeniden)
Reactie van het cycloalkaan met het halogeenbevattende anorganische hydraatmolecuul (HCl. HBr, HI). Omdat een zuur als reactant wordt gebruikt, wordt geen katalysator gebruikt. Bij deze reactie zal het cycloalkaan aanleiding geven tot a organisch halide met slechts één halogeenatoom in de keten. Nadat de cyclus is verbroken, hebben we de toevoeging van een waterstofatoom aan een van de koolstofatomen van de sigma-binding die verbroken was en een halogeen aan het andere koolstofatoom. De regel van Markovnikov gehoorzamen (H op de meest gehydrogeneerde koolstof en halogeen op de minst gehydrogeneerde koolstof).
Let op: Het komt alleen voor bij cyclopropaan en cyclobutaan.
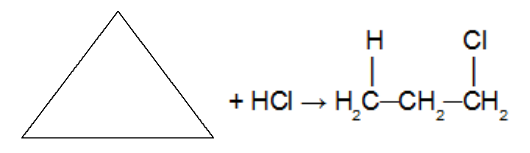
Toevoegingsreactie in cyclopropaan met zoutzuur
Let op: Het komt alleen voor bij cyclopropaan en cyclobutaan.
d) Hydratatie
Reactie van cycloalkaan met een watermolecuul in aanwezigheid van zwavelzuur en verhitting. Bij deze reactie zal het cycloalkaan aanleiding geven tot a mono-alcohol (alcohol met slechts één OH-groep in de keten). Nadat de cyclus is verbroken, hebben we de toevoeging van een waterstofatoom aan een van de koolstofatomen van de sigma-binding die was verbroken en een hydroxyl (OH) aan de andere koolstof. De regel van Markovnikov gehoorzamen (H op de meest gehydrogeneerde koolstof en hydroxyl op de minst gehydrogeneerde koolstof).
Let op: Het komt alleen voor bij cyclopropaan en cyclobutaan.

Toevoegingsreactie in cyclopropaan met zoutzuur
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/adicoes-ciclanos.htm
