Het belangrijkste onderscheidende kenmerk van redoxreacties is dat tegelijkertijd de ene chemische soort elektronen verliest (door te oxideren) en een andere elektronen verkrijgt (door te verminderen).
Bij bepaalde reacties is het echter mogelijk om waar te nemen dat er niet alleen sprake is van oxidatie en/of reductie. Hieronder staat een voorbeeld:
SnS + HCl + HNO3 → SnCl4 + S + NEE + H2O
Als we de oxidatiegetallen (Nox) van alle atomen in deze reactie berekenen, zoals beschreven in de tekst "Bepaling van het oxidatiegetal (Nox)", hebben we:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NEE + H2O
Laten we nu kijken welkestoffen leden variaties in hun Nox en bijgevolg oxideerden en verminderden:
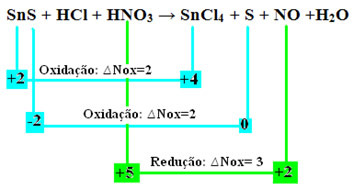
Merk op dat er twee oxidaties zijn opgetreden. Dus, in dat geval, hoe de chemische vergelijking in evenwicht te brengen?
Een belangrijk ding om in gedachten te houden dat van toepassing is op alle redoxreacties, is dat: het aantal weggegeven elektronen moet altijd gelijk zijn aan het aantal ontvangen elektronen.
Om dit type reactie in evenwicht te brengen, volgt u daarom dezelfde regels die zijn vastgelegd in de tekst "Redox-balancering”, echter, met slechts één wijziging: de bepaling van de Nox-variatie (∆Nox) van de soort die de twee oxidaties (SnS) heeft gegenereerd, is de som van de twee ∆Nox, wat ons de totale waarde van verloren elektronen zal geven:
- SnS: ∆Totale Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆Totaal NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
We kunnen dus doorgaan met de volgende stappen voor het balanceren:
- SnS: ∆Totaal NOx = 4 → 4 zal de HNO-coëfficiënt zijn3;
- HNO3: ∆Nox = 3 → 3 zal de coëfficiënt van SnS zijn.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + NEE + H2O
Voortzetting van het balanceren door middel van een proefmethode:
- Aangezien je 3 Sn en 3 S in het 1e lid hebt, zullen dit ook je coëfficiënten zijn in het 2e lid:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 J+NEE+H2O
- Daarmee bleef het 2e lid over met 12 Cl (3. 4 = 12), dus 12 is de coëfficiënt van de stof waarin Cl wordt gevonden in het eerste lid, dat HCl is:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NEE +H2O
- We hebben nu 16 H in het 1e lid (12 + 4 = 16), vandaar de coëfficiënt van H2O is gelijk aan 8, want 8 vermenigvuldigd met de waterstofindex, die 2 is, geeft 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NEE +8H2O
- Verder is er in het 1e lid ook 4 N, dus 4 is ook de coëfficiënt van N in het 2e lid:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NEE +8 H2O
Merk op dat de hoeveelheid zuurstof in de 1e ledemaat (3. 4 = 12) is gelijk aan de totale hoeveelheid van dat element in het 2e lidmaat (4 + 8 = 12). De reactie is dus in evenwicht.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm
