Een polaire verbinding (of stof) is er een met twee regio's met verschillende elektronendichtheden. Een van deze regio's heeft een positief karakter (wit gebied), en een ander heeft een negatief karakter (geel gebied), zoals we kunnen zien in de volgende weergave:

Vertegenwoordiging van regio's met verschillende lading in een polaire verbinding
Weet of een bepaalde composiet is polair impliceert het kennen van het type intermoleculaire kracht dat de interactie tussen zijn moleculen of met moleculen van andere stoffen, evenals het maken van aannames over hun oplosbaarheid en smeltpunten en kokend.
Bijvoorbeeld: met betrekking tot oplosbaarheid hebben polaire verbindingen een goed vermogen om op te lossen in polaire verbindingen. Wat betreft intermoleculaire krachten, afhankelijk van het geval, kunnen polaire verbindingen door krachten interageren permanente dipool- of waterstofbruggen (sterkte die ook resulteert in hogere smeltpunten en koken).
Hier zijn twee praktische manieren om te bepalen of een verbinding polair is of niet.
Bepaling van de polariteit door het aantal wolken en het aantal liganden
We kunnen bepalen of een composiet is polair door de relatie tussen het aantal gelijke atomen dat aan het centrale atoom is bevestigd en het aantal elektronenwolken in dat centrale atoom.
Opmerking: Een elektronenwolk is elke chemische binding tussen twee atomen, of een paar elektronen uit de valentieschil van een atoom die niet deelnemen aan een binding.
Als het aantal wolken in het centrale atoom verschilt van het aantal gelijke liganden in dat centrale atoom, hebben we een polaire verbinding. Volg de onderstaande voorbeelden voor een beter begrip:
1e voorbeeld: Blauwzuurmolecuul
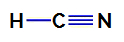
Structuurformule van blauwzuur
In blauwzuur is het centrale atoom koolstof, dat vier elektronen in zijn heeft valentie laag voor het behoren tot de IVA-familie van het periodiek systeem. Hoe koolstof een enkele binding maakt (twee elektronen deelt, met één elektron van elk atoom) betrokken) met waterstof en een drievoudige binding met stikstof, dus er zijn geen niet-bindende elektronen in het atoom centraal.
Zo is er in blauwzuur de aanwezigheid van twee elektronische wolken (een enkele binding en een drievoudige binding) en een ligand gelijk aan de andere. Daarom is het een polaire verbinding.
2e voorbeeld: Ammoniakmolecuul (NH3)
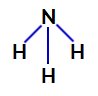
Ammoniak structuurformule
In ammoniak is het centrale atoom stikstof, dat vijf elektronen in zijn valentieschil heeft omdat het tot de VA-familie van het periodiek systeem behoort. Omdat stikstof een enkele binding maakt (delen van twee elektronen, met één elektron van ) elk betrokken atoom) met elk waterstofatoom nemen twee van de vijf elektronen niet deel aan bindingen.
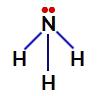
Niet-stikstofbindende elektronen in ammoniak
In ammoniak zijn er dus vier elektronenwolken (drie enkele bindingen en het niet-bindende elektronenpaar) en drie gelijke liganden (de drie waterstofatomen). Dus het is een polaire verbinding.
Bepaling van de polariteit door de dipoolmomentvector van een verbinding
We kunnen bepalen of een composiet is polair door de analyse van de resulterende dipoolmomentvector in zijn structuurformule, rekening houdend met zijn moleculaire geometrie en het verschil van elektronegativiteit tussen de betrokken atomen.
Opmerking: Aflopende volgorde van elektronegativiteit van de elementen: F > O > N > Cl > Br > I > S > C > P > H.
Wanneer de som van de vectoren die in het molecuul aanwezig zijn verschillend is van nul, zal de verbinding polair zijn. Volg de volgende voorbeelden voor een beter begrip:
1e voorbeeld: trichloormethaan molecuul
Trichloormethaan is een verbinding die presenteert tetraëdrische geometrie, zoals we kunnen zien in de onderstaande structuurformule:

Structuurformule van trichloormethaan
Om erachter te komen of het een polaire verbinding is, moeten we eerst de dipoolmomentvectoren (pijlen die aangeven welk atoom stabieler is dan de andere) eerst in de structurele plaatsen, zoals in het volgende voorbeeld:
Opmerking: Chloor is een meer elektronegatief element dan koolstof. Op zijn beurt is koolstof een meer elektronegatief element dan waterstof.
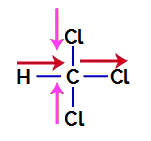
Dipoolmomentvectoren in trichloormethaan
Vectoren in roze kunnen worden weergegeven door +x en -x, omdat ze dezelfde richting (verticaal) en tegengestelde richtingen (omhoog en omlaag) hebben. Vectoren in rood worden weergegeven door +x, omdat ze dezelfde richting en dezelfde richting hebben. Dus de resulterende dipoolmomentvector (som van de vectoren) wordt weergegeven door:
μR = (+x) + (-x) + (+x) + (+x)
μR = +X – x + x + x
μR = 2x
Aangezien de resulterende dipoolmomentvector niet nul is, hebben we a polaire verbinding.
2e voorbeeld: water molecuul
Water is een verbinding die presenteert hoekige geometrie, zoals we kunnen zien in de onderstaande structuurformule:
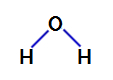
Structuurformule van water
Om erachter te komen of het een polaire verbinding is, moeten we eerst de dipoolmomentvectoren (pijlen die aangeven welk atoom stabieler is dan de andere) in de structuur plaatsen, zoals hieronder weergegeven:
Opmerking: Zuurstof is een meer elektronegatief element dan waterstof.
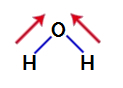
dipoolmomentvectoren in water
Aangezien de twee vectoren in de structuur van water diagonaal over elkaar liggen, moeten we de parallellogramregel gebruiken. In deze regel, wanneer we de basen van de vectoren koppelen, hebben we de creatie van een resulterende vector (die de twee eerder gebruikte vervangt), zoals in het volgende model:
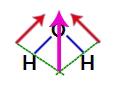
Resulterende vector in de structuurformule van water
Omdat het watermolecuul een enkele vector heeft, is de resulterende dipoolmomentvector dus niet nul, dat wil zeggen dat we een polaire verbinding.
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm
