Buffer oplossing het is een homogeen mengsel dat de pH of pOH niet verandert wanneer kleine hoeveelheden sterk zuur of sterke base aan dit mengsel worden toegevoegd. Het mengsel verandert echter de pH of pOH niet alleen als het een van de twee onderstaande samenstellingen heeft:
Plug zuur (pH lager dan 7):
Het heeft een zwak zuur gemengd met a zout oplosbaar die hetzelfde anion heeft, zoals blauwzuur (HCN) en kaliumcyanide (KCN), die hetzelfde cyanideanion (CN) hebben.
Basisbuffer (pH hoger dan 7):
Baseren zwak gemengd met een zout dat hetzelfde kation heeft, zoals zinkhydroxide [Zn(OH)2] en zinkchloride (ZnCl2), die hetzelfde zinkkation hebben (Zn+2).
Om de invloed te begrijpen die een bufferoplossing heeft op het opnemen van een sterk zuur of base, is het belangrijk om te onthouden wanneer zuren en basen als sterk worden beschouwd:
→ Rangschikking van bases in termen van sterkte
sterk: basen met chemische elementen uit de families IA (alkalimetalen) en IIA (aardalkalimetalen), met uitzondering van magnesium;
zwak: basen die het element magnesium hebben en een ander, zolang het niet tot de IA- en IIA-families behoort.
→ Classificatie van zuur voor kracht
a) Voor hydraten (zuurstofvrije zuren):
sterk: alleen HCl, HBr en HI;
gematigden: alleen HF;
zwak: elk ander hydroxide.
b) Voor oxyzuren (zuren met zuurstof):
sterk: wanneer de aftrekking van het aantal zuurstofatomen door het aantal waterstofatomen gelijk is aan of groter is dan 2;
gematigden: wanneer de aftrekking van het aantal zuurstofatomen door het aantal waterstofatomen gelijk is aan 1;
zwak: wanneer de aftrekking van het aantal zuurstofatomen door het aantal waterstofatomen gelijk is aan of kleiner is dan 0.
Invloed van het toevoegen van een sterke base aan een buffer
Laten we, om het uit te leggen, de gebruiken buffer oplossing gevormd door zinkhydroxide [Zn(OH)2] en het oplosbare zout van zinkchloride (ZnCl2), die een kleine hoeveelheid sterke natriumhydroxide (NaOH) base zal ontvangen. Zie de saldi die aanwezig zijn in deze bufferoplossing:
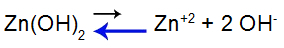
Basis dissociatie evenwichtsvergelijking
Balans verschuift naar links omdat de basis zwak is.
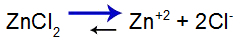
Zout dissociatie evenwichtsvergelijking
De balans verschuift naar rechts omdat zout oplosbaar is.
De sterke basis heeft de volgende balans:
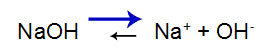
Basis dissociatie evenwichtsvergelijking
Balans verschuift naar rechts omdat de basis sterk is.
De toegevoegde sterke base maakt het hydroxide-anion (OH) vrij in water-), die een hoge affiniteit heeft voor zinkkationen (Zn+2) van het zout in het tweede evenwicht. De associatie tussen hydroxide en zink vormt zinkhydroxide:
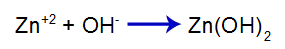
basisvormingsvergelijking
Dus de OH- van base vermindert de hoeveelheid zink in het tweede evenwicht en verhoogt de hoeveelheid base [Zn(OH)2], waardoor het verder dissociëert en Zn-kationen vrijgeeft+2 in het eerste evenwicht. Omdat we geen verandering zullen hebben in de hoeveelheid hydroxide in het medium, verandert de pH daarom niet.
Invloed van het toevoegen van een sterk zuur aan een buffer
Laten we om dit uit te leggen de buffer gebruiken die wordt gevormd door zinkhydroxide [Zn(OH)2] en door het oplosbare zout van zinkchloride (ZnCl2), die een kleine hoeveelheid waterstofjodide (HI) zal ontvangen, wat sterk is. Zie de saldi aanwezig in de dop:
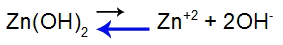
Basis dissociatie evenwichtsvergelijking
Balans naar links verschoven omdat de basis zwak is.
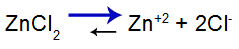
zoutbalansvergelijking
Balans verschoven naar rechts omdat zout oplosbaar is.
Sterk zuur heeft de volgende balans:
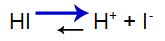
Zuurbalansvergelijking
Balans naar rechts verschoven omdat het zuur sterk is.
Het toegevoegde zuur produceert het hydroniumkation in water (H+), die een hoge affiniteit heeft voor hydroxide-ionen (OH-) van de basis. De associatie tussen hydronium en hydroxide vormt een watermolecuul:
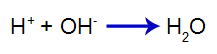
water vorming vergelijking
dus de H+ van zuur vermindert de hoeveelheid hydroxiden in het eerste evenwicht, waardoor de dissociatie van basen toeneemt. Omdat we geen verandering zullen hebben in de hoeveelheid hydroxide in het medium, verandert de pH daarom niet.
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-solucao-tampao.htm