Osmose is de beweging van water die plaatsvindt in cellen door een semi-permeabel membraan.
In dit proces gaan de watermoleculen van een minder geconcentreerd medium naar een meer geconcentreerd medium.
Daarom dient osmose om de twee zijden van het membraan in evenwicht te brengen, waardoor het opgeloste stofrijke medium wordt verdund door het oplosmiddel, dat water is.
Hoe ontstaat osmose?
Osmose wordt beschouwd als een passief transport, zoals bij de doorgang door het membraan er wordt geen energie verspild.
Tijdens het proces van osmose heeft water, dat het oplosmiddel is, de neiging om het semi-permeabele membraan te passeren om de concentratie van de oplossing in evenwicht te brengen. Deze actie wordt uitgevoerd totdat de osmotische druk is gestabiliseerd.
Daarom verplaatst het water zich natuurlijk van de minder geconcentreerde regio naar de meer geconcentreerde.
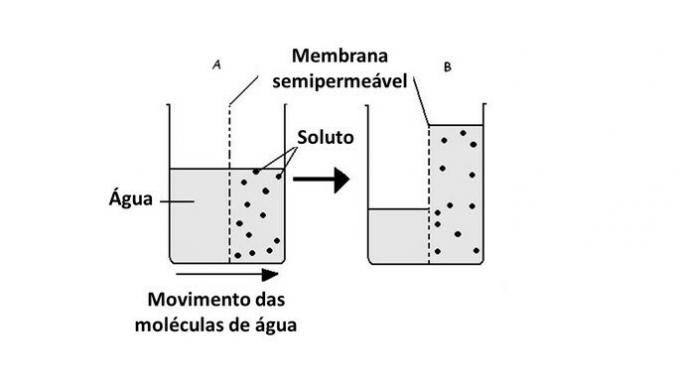
De passage van water van het ene medium naar het andere gebeurt in cellen met behulp van transporteiwitten in het membraan, aquaporines. Osmose treedt dus op wanneer er een verschil in concentratie is tussen de externe en interne omgeving van de cel.
Het resultaat van osmose wordt gebruikt in de nutriëntenuitwisselingsprocessen van dierlijke en plantaardige cellen.
Lees ook over Passief transport en Actief transport.
Hypotone, isotone en hypertone oplossing
Zoals we hebben gezien, heeft het osmoseproces tot doel de concentraties van oplossingen gelijk te maken, totdat een evenwicht is bereikt. Hiervoor hebben we de volgende soorten oplossingen:
- hypertonische oplossing: presenteert hogere osmotische druk en opgeloste stofconcentratie.
- hypotone oplossing: presenteert lagere osmotische druk en opgeloste stofconcentratie.
- Isotone oplossing: de opgeloste stofconcentratie en de osmotische druk zijn gelijk, waardoor een evenwicht wordt bereikt.
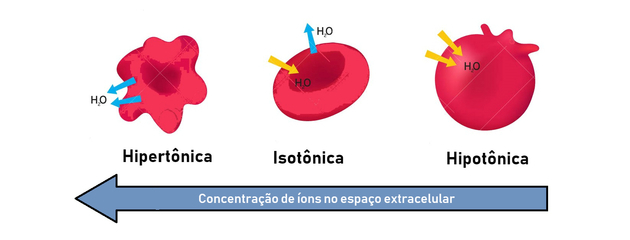
Daarom vindt osmose plaats tussen een hypertone (meer geconcentreerde) en hypotone (minder geconcentreerde) manier om een evenwicht te genereren.
osmose voorbeelden
In cellen is het plasmamembraan een omhulsel gevormd door een lipide dubbellaag, die de beweging van water in de cel belemmert. Er zijn echter eiwitten die gespecialiseerd zijn in de structuur ervan, aquaporines, die fungeren als kanalen die de doorgang van watermoleculen vergemakkelijken.
In een hypertone omgeving hebben cellen de neiging te krimpen als ze water verliezen. Een cel die in een hypotoon medium is geplaatst, kan opzwellen totdat hij breekt, omdat er water in de cel stroomt.
Zie hieronder hoe osmose ontstaat in dierlijke en plantaardige cellen.
Osmose in dierlijke cel
wanneer een dierlijke cel, zoals rode bloedcellen, worden blootgesteld aan media met verschillende concentraties, vindt de beweging van water in de cel als volgt plaats:
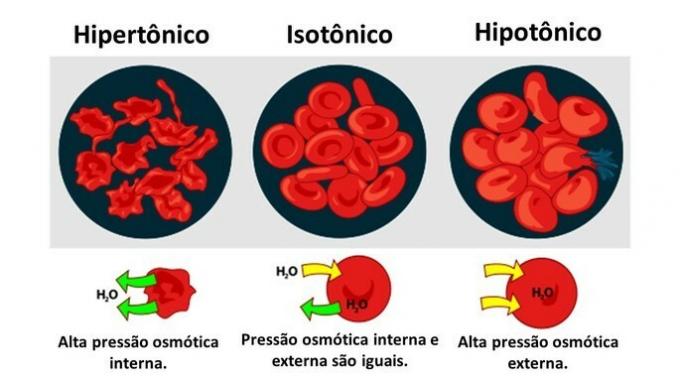
Wanneer het medium rijk is aan opgeloste stof, een oplossing die hypertoon is ten opzichte van het cytoplasma, verliezen cellen water aan het medium en verdorren.
Wanneer het medium arm is aan opgeloste stof, een hypotone oplossing, hebben watermoleculen de neiging de cel binnen te gaan en, hoewel het membraan resistent is, kan er, afhankelijk van de hoeveelheid, verstoring optreden.
Plantencel osmose
De beweging van water in plantencellen vindt plaats tussen de cellulaire vacuole en de extracellulaire omgeving.
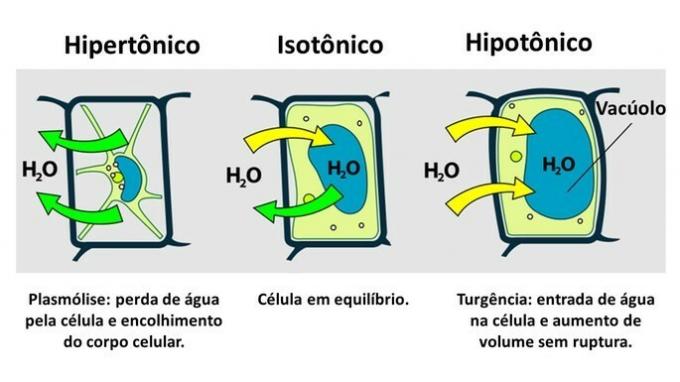
DE plantencel het heeft, naast het plasmamembraan, een zeer resistente celwand, die wordt gevormd door cellulose.
Daarom is de plantencel, in tegenstelling tot de dierlijke cel, bestand tegen verstoring wanneer deze in een hypotone omgeving wordt ingebracht, waar water de cel binnendringt. De cel zwelt op, waardoor het volume toeneemt, maar de celwand voorkomt scheuren.
Het verlies van water door een plantencel, die in een hypertone omgeving wordt ingebracht, wordt plasmolyse genoemd. Aan de andere kant wordt het binnendringen van water in de vacuole wanneer de cel zich in een hypotoon medium bevindt, turgency genoemd, wanneer er een toename van het celvolume is.
Hoe beïnvloedt osmotische druk osmose?
Een opgeloste stof is elke stof die kan worden verdund in een oplosmiddel, zoals suiker opgelost in water. Terwijl osmotische druk de druk is die wordt veroorzaakt om water te laten bewegen.
Aangezien osmose een proces is dat plaatsvindt van het minst geconcentreerde (hypotonische) tot het meest geconcentreerde (hypertone) medium in zoek naar balans, osmotische druk is de druk die op een systeem wordt uitgeoefend om osmose te voorkomen van nature.
Daarom, hoe groter het concentratieverschil tussen de hypertone en hypotone media, des te groter moet de osmotische druk zijn die op de meer geconcentreerde oplossing wordt uitgeoefend om osmose te voorkomen.
Leer meer over osmotische druk.
Wat is omgekeerde osmose en hoe werkt het?
Omgekeerde osmose is de doorgang van water in de tegenovergestelde richting van osmose. Zo verplaatst water zich van een meer geconcentreerde oplossing naar een minder geconcentreerde.
Omgekeerde osmose vindt plaats door een druk uit te oefenen die groter is dan de natuurlijke osmotische druk.
Omdat het semi-permeabele membraan alleen oplosmiddel (zuiver water) doorlaat, houdt het opgeloste stoffen vast.
Een voorbeeld van omgekeerde osmose is de omzetting van zout water in zoet water door het ontziltingsproces.
Leer meer over omgekeerde osmose.
Verschil tussen osmose en diffusie
Diffusie is de passage van zeer kleine moleculen van gassen en opgeloste stoffen opgelost in water door de plasma membraan. In dit geval zullen de opgeloste moleculen verschuiven van het meer geconcentreerde medium naar het minder geconcentreerde medium. Ze bewegen langs een concentratiegradiënt en verspreiden zich over de beschikbare ruimte.
DE gefaciliteerde diffusie het is de doorgang, door het membraan, van stoffen die niet oplossen in lipiden, met behulp van eiwitten die de lipidedubbellaag doordringen.
Net als osmose wordt diffusie ook als een passief transport, omdat het optreedt in het voordeel van een concentratiegradiënt.
Nieuwsgierigheid
De uitdrukking "leren door osmose" wordt veel gebruikt door studenten die nieuwe inhoud willen leren zonder te hoeven studeren, dat wil zeggen zonder moeite te doen.
Lees ook:
- Opgeloste en oplosmiddel
- Natrium- en kaliumpomp
- Selectieve permeabiliteit


