De wet van Hess is bedacht door de Zwitserse chemicus Germain H. Hess (1802-1850), die wordt beschouwd als een van de grondleggers van de thermochemie. Zijn wet zei:

Dat wil zeggen, de ΔH hangt alleen af van de enthalpiewaarden van de reagentia en producten, zoals in de uitdrukking:
| ΔH = ΔHreagentia + Hproducten |
Beschouw bijvoorbeeld de reactie waarbij 1 mol water (H2O) wordt in gasvormige toestand omgezet in water. Deze reactie wordt tweemaal uitgevoerd; we hebben echter verschillende paden gekozen:
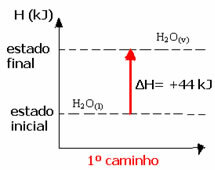
(1) Het werd uitgevoerd in een enkele stap:
H2O(1) → H2O(v) ΔH= +44 kJ
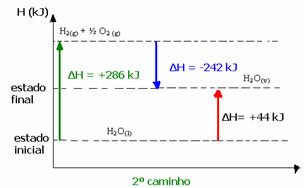
(2e) Het werd in twee fasen uitgevoerd:
1e stap: H2O(1) → H2(g) + de2 (g) ΔH= +286 kJ
2e graad: H2(g) + de2 (g) → H2O(v) ΔH= -242 kJ
H2O(1) → H2O(v) ΔH= +44 kJ
Merk op dat ongeacht of er één of twee stappen zijn uitgevoerd, de enthalpieverandering (ΔH) altijd 44 kJ is. Dit komt omdat ΔH de algebraïsche som is van de ΔH-waarden van de stappen waaruit het proces bestaat, dat wil zeggen van de tussenprocessen:
| ΔH = ΔH1 + H2 + H3 + ... |
In het tweede geval was de totale ΔH van de reactie bijvoorbeeld de som van de ΔH van de eerste stap (ΔH= +286 kJ) met die van de tweede (ΔH= -242 kJ). Zo verkregen we dezelfde reactiewaarde met een enkele stap:
ΔH = (+286 + (-242)) kJ
ΔH = (+286 -242) kJ
ΔH = +44 kJ
Daarom zijn we alleen geïnteresseerd in de begin- en eindwaarden. In dit geval komt de begintoestand overeen met H2O(1) en het einde van H2O(v).
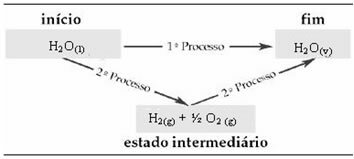
Deze wet is erg belangrijk geworden in de thermochemie, omdat de ΔH van bepaalde chemische reacties niet experimenteel kan worden bepaald. Volgens de wet van Hess kan de enthalpie van dit type reactie echter worden berekend uit de enthalpie van andere reacties (tussenreacties).
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Brazilië School Team
