Voor u om het fenomeen van te begrijpen ionisatie het is eerst nodig om te weten wat ionen zijn. Let op onderstaande uitleg:
Elk atoom heeft hetzelfde aantal protonen en elektronen; daarom is elk atoom elektrisch neutraal. Verder hebben stoffen gevormd door groepen atomen ook een elektrische ladingsbalans, omdat ze elektrisch neutraal zijn.
Echter, een atoom of een groep atomen kan elektronen verliezen of winnen; wanneer dat gebeurt, verliezen ze hun neutraliteit en worden ze ionen.
Als het atoom of de groep atomen elektronen verliest, is het positief geladen en wordt het een ion genaamd kation. Als u echter elektronen krijgt, zal de lading negatief zijn en het ion a anion.
Anorganische stoffen zijn ionisch of kunnen ionen vormen.
Een van de manieren om ionen te vormen is door moleculaire stoffen in water te plaatsen, dat wil zeggen gevormd door covalente bindingen, waarin elektronen worden gedeeld.
Als we bijvoorbeeld de elektrische geleiding van zoutzuur (HCl) in een waterige oplossing (waterstofchloride) testen, opgelost in water), zullen we zien dat de oplossing elektrolytisch is, dat wil zeggen, het geleidt een elektrische stroom, omdat er ionen in zitten oplossing.

Dit betekent dat water als reactant fungeerde en ionen vormde uit zoutzuur. Dit gebeurt volgens onderstaande reactie:
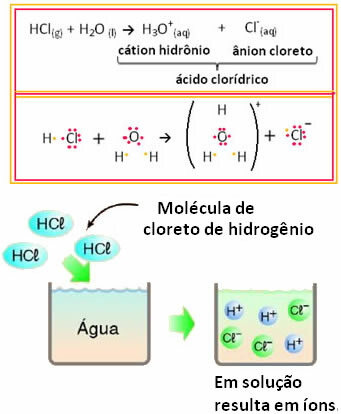
Merk op dat voordat waterstofchloride in water werd gedaan, er geen ionen waren. De moleculen reageerden echter met water en vormden positieve H-ionen3O+ (kationen) en negatieven Cl- (anionen). Omdat chloor meer elektronegatief is dan waterstof, trekt het het elektronenpaar van de covalente binding ernaast aan en vormt het het anion. Waterstof daarentegen wordt aangetrokken door zuurstof in water, dat meer elektronegatief is dan chloor; en tussen waterstof en zuurstof wordt een covalente binding gevormd, die aanleiding geeft tot het hydroniumkation. Dit fenomeen van ionenvorming heetionisatie.
Op basis van bovenstaande uitleg kunnen we ionisatie als volgt definiëren:

Merk op dat de ionen eerder niet bestonden, want als ze wel bestonden, zoals in het geval van het oplossen van ionische verbindingen, zouden we een ionische dissociatie hebben en geen ionisatie.
Alle zuren die in contact komen met water ondergaan ionisatie. Niet elke moleculaire verbinding ondergaat echter ionisatie.Bijvoorbeeld suiker (C12H22O11) is moleculair, maar wanneer het in water wordt geplaatst, worden er geen ionen gevormd, het lost gewoon op en ontstaat een niet-elektrolytische moleculaire oplossing die geen elektriciteit geleidt.
Door Jennifer Fogaça
Afgestudeerd in scheikunde