Een halogenide is een organische verbinding die ten minste één halogeenatoom heeft. – dat wil zeggen, chemische elementen uit familie 17 of VII van het periodiek systeem (F, Cl, Br, I of generiek: X) – gehecht aan een groep afgeleid van een koolwaterstof.
RX (waarbij X = F, Cl, Br of I)
Enkele halogeniden worden hieronder getoond:

Jodium is het meest reactief van allemaal en fluor het minst, omdat de bindingsenergie tussen halogeen en koolstof toeneemt vanuit de richting van jodium naar fluor.
Een ander punt is dat de reactiviteit ook in deze zin toeneemt:

Deze reactiviteit vindt dus gemakkelijker plaats in tertiaire koolstofhalogeniden, vanwege het karakter dat wordt verkregen door de koolstof gekoppeld aan het organische halide:

Zo wordt de substituentgroep, zoals de OH die de alcohol zal vormen, sterker aangetrokken door de tertiaire koolstof, die een positief karakter heeft (1+), en de substitutie is gemakkelijker.
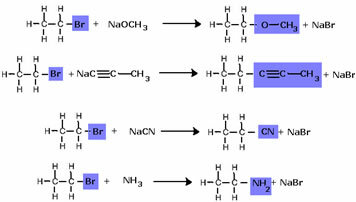
Halogeniden kunnen reacties ondergaan waardoor we praktisch alle andere organische functies kunnen verkrijgen (o.a. alcohol, ether, alkyn, cyanide of nitril, amine). In de praktijk is dit echter niet haalbaar, aangezien halogeniden zeer dure verbindingen zijn.
Om bijvoorbeeld een alcohol te produceren, laat men een halogenide reageren met een sterke base, zoals natriumhydroxide, in een waterig medium. Laten we hieronder een voorbeeld bekijken, waarin uit de alkalische hydrolyse van ethylchloride (chloorethaan) ethanol wordt gevormd:
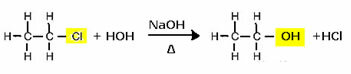
Merk op dat de halogenidegroep werd vervangen door de OH, de functionele alcoholgroep. Hetzelfde schema wordt gevolgd voor de vorming van andere groepen, waarbij alleen het reagens wordt onderscheiden:
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Brazilië School Team
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/reacoes-substituicao-haletos-organicos.htm
